题目内容
【题目】钼是一种重要的过渡元素,钼钢是制火箭发动机的重要材料,钼酸钠晶体(Na2MoO4·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼矿(主要成分MoS2)为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:
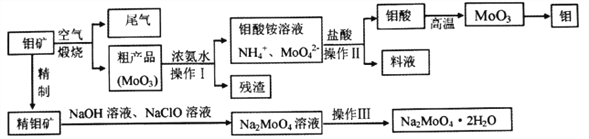
(1)Na2MoO4·2H2O中元素的价态为_________,工业煅烧钼矿的尾气用过量的氨水处理,反应的离子方程式为________________________________________________。
(2)由图中信息可以判断MoO3是____________氧化物。(填“酸性”、“碱性”或“两性”)
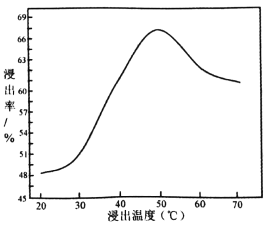
(3)采用 NaClO氧化精钼矿的方法将矿石中的钼浸出,该过程放热,其化学反应为:NaClO+MoS2+NaOH→Na2MoO4+Na2SO4+NaCl+H2O,该反应配平后, NaClO与MoS2的系数比为____________。随着温度升高,钼的浸出率的变化如图,高于50℃后浸出率降低的可能原因是____________________________________(写两点)。
(4)操作Ⅲ主要包括____________,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是____________________________________。
(5)锂和MoS2可充电电池的工作原理为xLi+nMoS2![]() Li(MoS2)n,则电池充电时阳极上的电极反应式为______________________。
Li(MoS2)n,则电池充电时阳极上的电极反应式为______________________。
(6)某工厂用1.00×103吨粗钼矿(含MoS216.00%)制备钼单质,已知冶炼过程中,钼的损耗率为10.00%,则最终得到钼单质质量为___________吨。
【答案】 +6 SO2+2NH3·H2O=2NH4++SO32-+H2O 酸性 9∶1 随着温度升高,其它金属杂质离子浸出也增多,沉淀了MoO42;该反应为放热反应,升温使平衡逆移;NaClO不稳定,随温度升高而分解损耗。 蒸发浓缩、降温结晶、过滤 取水洗液少量于试管中,加入AgNO3溶液,若无沉淀产生即证明钼酸已洗净 Lix(MoS2)n-xe-=nMoS2+xLi+ 86.4
【解析】(1)Na2MoO4·2H2O中Na为+1价,O为-2价,所以Mo为+6价;根据题意可知工业煅烧钼矿的尾气为二氧化硫,用氨水吸收的离子方程式为:SO2+2NH3·H2O=2NH4++SO32-+H2O
(2)由图中信息可知MoO3可以与氨水反应生成MoO42-,所以是酸性氧化物;
(3)利用化合价升降法配平NaClO中Cl的化合价由+1变为-1,MoS2中Mo的化合价由+4变为+6,S由-1变为+6,配平后的方程式为:9NaClO+MoS2+6NaOH=Na2MoO4+2Na2SO4+9NaCl+3H2O,所以NaClO与MoS2的系数比为9:1;随着温度升高,其它金属杂质离子浸出也增多,沉淀了MoO42;该反应为放热反应,升温使平衡逆移;NaClO不稳定,随温度升高而分解损耗。
(4)操作Ⅲ的目的是让溶液中析出晶体,操作应该是:蒸发浓缩、降温结晶、过滤;检验钼酸是否洗涤干净可以检验洗涤液中中是否含有氯离子,具体操作为:取水洗液少量于试管中,加入AgNO3溶液,若无沉淀产生即证明钼酸已洗净。
(5)电池充电时为电解池,阳极上应该发生失电子的反应,所以电极反应为:Lix(MoS2)n-xe-=nMoS2+xLi+;
(6)根据题意列出计算式![]() ,故最终得到的钼单质质量是86.4吨。
,故最终得到的钼单质质量是86.4吨。