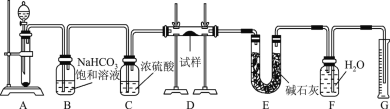
��Ŀ����
����Ŀ�����ӷ�Ӧ��������ԭ��Ӧ������ѧ��ѧ����Ҫ�ķ�Ӧ���͡���ش��������⣺
(1)�ڷ������ӷ�Ӧ�ķ�Ӧ����������У�һ��������_____________��
A������ B�������� C������� D���� E��������
(2)���dz���ͼʾ�ķ�����ʾ��ͬ��Ӧ����֮��Ĺ�ϵ����ֽⷴӦ��������ԭ��Ӧ�ɱ�ʾΪ��ͼ����ͼΪ���ӷ�Ӧ��������ԭ��Ӧ���û���Ӧ����֮��Ĺ�ϵ�����ʾ���ӷ�Ӧ��������ԭ��Ӧ���û���Ӧ����ĸ������_____________

(3)��NaBr��Һ����AgC1�����У�����AgBr��ɫ�����������ӷ�Ӧ����������������AgCl��AgBr��Ƚϣ��ܽ�Ƚϴ����_____________��
(4)��֪ij������ԭ��ӦAu2O3 + 4Na2S2O3 + 2H2O ��Au2O+ 2Na2S4O6 +4NaOH
�� �õ����ű������ת�Ƶķ������Ŀ________________��
�� ��Ӧ�У���������Ԫ����______________����������_________________��
�� �Ƚϸ÷�Ӧ����������������������������ǿ��_________________________��
���𰸡�C��E C A B AgCl 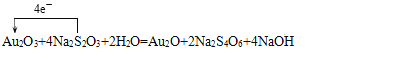 S ���� Au2O3 Na2S4O6 ��Au2O3 �� Au2O3 �� Na2S4O6
S ���� Au2O3 Na2S4O6 ��Au2O3 �� Au2O3 �� Na2S4O6
��������
����������ԭ��Ӧ�ı��ʺ��������������ݵ����ŵĻ��ƹ��ɷ��������ݻ�ѧ��Ӧ�����ͷ��������
(1)���ӷ�Ӧ�������Ӳμӵķ�Ӧ�������������ǻ�������һ���������±��������ܷ�Ӧ�����ӣ��ʴ�Ϊ��CE��
(2) �û���Ӧһ���л��ϼ۵�������һ������������ԭ��Ӧ����B�����û���Ӧ����A����������ԭ��Ӧ��������֪CΪ���ӷ�Ӧ����ǰ���߾��н��档�ʴ�Ϊ��C�� A�� B��
(3) ���ݳ����ܽ�ƽ����ɣ�����������ɸ����ܵ����ʣ��ɵõ���AgBr���ܽ��С��AgCl���ʴ�Ϊ��AgCl��
(4) Au��+3�۽���+1�����õ����ӹ�Au2O3��������������ԭ����Au2O���ʻ�ԭ����ΪAu2O��Na2S4O6��S��ƽ�����ϼ�Ϊ+ ![]() ����Na2S2O3����ԭ��������������Na2S4O6����Na2S4O6�������������S���������������ɻ�ԭ��ָ���������������ԣ�������>���������ԭ�ԣ���ԭ��>��ԭ����ʴ�Ϊ��
����Na2S2O3����ԭ��������������Na2S4O6����Na2S4O6�������������S���������������ɻ�ԭ��ָ���������������ԣ�������>���������ԭ�ԣ���ԭ��>��ԭ����ʴ�Ϊ��
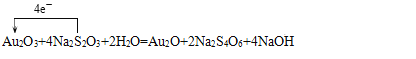 �� S ����Au2O3��Na2S4O6 ��Au2O3��
�� S ����Au2O3��Na2S4O6 ��Au2O3��