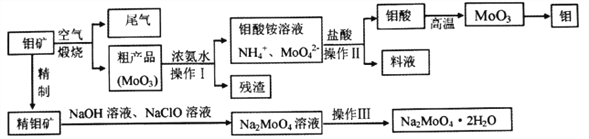
题目内容
【题目】某研究性学习小组拟提纯粗盐并取苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:

请根据上述流程,回答以下问题:
(1)要从橙红色液体中分离出溴,可采取的操作是____________。
(2)试剂A中如果有两种溶质,它们是_____ 、 ______;如果是一种溶质,它是________。试剂B是__________。
(3)检验SO42- 已除尽的方法是__________________________________________。
(4)操作②名称_______________。
(5)在操作②之后的无色溶液中加入稀盐酸的目的是______________________________。
【答案】蒸馏 BaCl2 KOH Ba(OH)2 K2CO3 静置,在上层清液中继续加入BaCl2溶液,若没有白色沉淀,则SO42-已除尽 过滤 除去未反应的OH-和CO32-
【解析】
根据粗盐的提纯原理、离子共存原理分析实验过程。
(1) 由于溴和CCl4的沸点不同,可用蒸馏的方法分离;
(2)无色溶液中,仍含有K+、Mg2+、SO42-、Cl-,除去溶液中的Mg2+、SO42-,应分别加入过量的BaCl2、KOH、K2CO3,类似于粗盐的提纯,加入过量BaCl2可除去SO42-,加入过量KOH溶液可除去Mg2+,最后加入K2CO3可除去BaCl2,故试剂A中如果有两种溶质,它们是BaCl2 和 KOH,如果是一种溶质,它是Ba(OH)2,试剂B即为:K2CO3;故答案为:BaCl2 , KOH ,Ba(OH)2 , K2CO3 ;
(3) 检验SO42- 已除尽的方法是溶液静置后,在上层清液中继续加入BaCl2溶液,若没有白色沉淀,则SO42-已除尽;
(4)由于加入试剂A和试剂B反应后,生成Mg(OH)2和硫酸钡、碳酸钡沉淀,故操作②为过滤;
(5)由于为了让上步反应进行完全,将Mg2+和Ba2+完全沉淀,BaCl2 ,KOH, K2CO3一定过量,故反应后溶液中仍含有CO32-和OH-,故在操作②之后的无色溶液中加入稀盐酸目的是:除去未反应的OH-和CO32-。

【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1