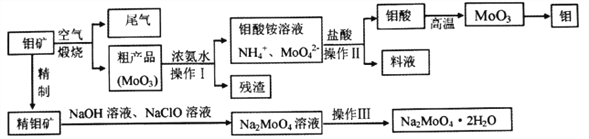
题目内容
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-Q kJ/mol(Q>0)
2NH3(g) ΔH=-Q kJ/mol(Q>0)
据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
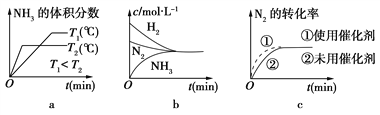
(2)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
(3)某温度下,若把2 mol N2与6 mol H2置于体积为1 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1_______Q。
【答案】 ![]() 小 a、c 1/48 < < <
小 a、c 1/48 < < <
【解析】试题分析:(1)①化学平衡常数=![]() ;②该反应放热,升高温度平衡逆向移动;(2)该反应放热,升高温度平衡逆向移动,温度越高氨气的体积分数越小;达到平衡时氮气、氢气、氨气的浓度不一定相等;加入催化剂能加快反应速率,但平衡不移动;(3)利用“三段式”计算平衡常数;(4)合成氨反应,气体系数和减小,恒压密闭容器与恒容密闭容器相比,恒压密闭容器相当于加压;
;②该反应放热,升高温度平衡逆向移动;(2)该反应放热,升高温度平衡逆向移动,温度越高氨气的体积分数越小;达到平衡时氮气、氢气、氨气的浓度不一定相等;加入催化剂能加快反应速率,但平衡不移动;(3)利用“三段式”计算平衡常数;(4)合成氨反应,气体系数和减小,恒压密闭容器与恒容密闭容器相比,恒压密闭容器相当于加压;
解析:(1)①N2(g)+3H2(g) ![]() 2NH3(g) 化学平衡常数表达式
2NH3(g) 化学平衡常数表达式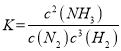 ;②该反应放热,升高温度平衡逆向移动,所以温度越高,其平衡常数的值越小;(2)该反应放热,升高温度平衡逆向移动,温度越高氨气的体积分数越小,根据图像a,
;②该反应放热,升高温度平衡逆向移动,所以温度越高,其平衡常数的值越小;(2)该反应放热,升高温度平衡逆向移动,温度越高氨气的体积分数越小,根据图像a, ![]() ,
, ![]() 时氨气的体积分数减小,故a正确;达到平衡时氮气、氢气、氨气的浓度不一定相等,故b错误;加入催化剂能加快反应速率,但平衡不移动,故c正确;
时氨气的体积分数减小,故a正确;达到平衡时氮气、氢气、氨气的浓度不一定相等,故b错误;加入催化剂能加快反应速率,但平衡不移动,故c正确;
(3)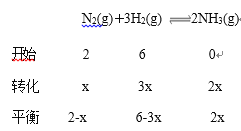
![]()
x=![]() ,
, 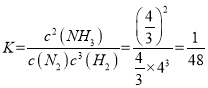 ;
;
(4)合成氨反应,气体系数和减小,恒压密闭容器与恒容密闭容器相比,恒压密闭容器相当于加压,加压平衡正向移动,所以a<b;生成氨气越多,放出的热量越多,所以Q1<Q2;反应可逆,所以1 mol N2和3 mol H2不能完全反应生成2mol氨气,所以Q1<Q。