题目内容
5.下列根据实验操作和实验现象所得出的结论不正确的是( )| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向沸水中滴加少量饱和氯化铁溶液,加热至溶液呈红褐色,用激光笔照射 | 有丁达尔效应 | 红褐色液体为胶体 |
| B | 向溶液X中加入NaHCO3粉末 | 产生无色气体 | X一定属于酸 |
| C | 向淀粉NaI溶液中加入氯水 | 溶液变蓝 | 氧化性:Cl2>I2 |
| D | 将气体X分别通入溴水和酸性高锰酸钾溶液 | 两溶液均褪色 | X可能是SO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Fe(OH)3胶体的制备方法是:向沸水中滴加少量饱和氯化铁溶液,加热至溶液呈红褐色即可;
B.产生无色气体,说明溶液呈酸性;
C.向淀粉NaI溶液中加入氯水,溶液变蓝,说明氯气置换出碘;
D.二氧化硫具有还原性,能被强氧化剂氧化.
解答 解:A.向沸水中滴加少量饱和氯化铁溶液,加热至溶液呈红褐色,FeCl3水解生成Fe(OH)3胶体,胶体有丁达尔效应,故A正确;
B.产生无色气体,说明溶液呈酸性,但不一定是酸,如硫酸氢钠,故B错误;
C.向淀粉NaI溶液中加入氯水,说明氯气置换出碘,发生Cl2+2I-=2Cl-+I2,可说明氧化性:Cl2>I2,故C正确;
D.二氧化硫具有还原性,能被强氧化剂溴、酸性高锰酸钾溶液氧化而导致溴水、酸性高锰酸钾溶液褪色,故D正确.
故选B.
点评 本题考查化学实验方案的评价,涉及物质的性质的比较,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意把握物质的性质的异同以及实验的原理和操作方法,难度不大.

练习册系列答案
相关题目
16.按要求回答下列问题:
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100mL 3mol•L-1的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(2)常温下,向一定体积的0.1mol•L-1的醋酸溶液中加水稀释后,下列说法正确的是CD.
A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中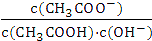 不变 D.溶液中
不变 D.溶液中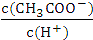 减小
减小
(3)常温下将0.15mol•L-1的稀硫酸V1mL与0.1mol•L-1的NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积的变化忽略不计).
(4)常温下,浓度均为0.1mol•L-1的下列五种溶液的pH如表所示:
①根据表中数据,将浓度均为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最小的是A.
A.HCNB.HClO C.H2CO3D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.NaHCO3+HCN=NaCN+H2O+CO2↑
(5)几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)2]<Ksp[Mg(OH)2](填“>”“=”或“<”).
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100mL 3mol•L-1的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(2)常温下,向一定体积的0.1mol•L-1的醋酸溶液中加水稀释后,下列说法正确的是CD.
A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中
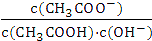 不变 D.溶液中
不变 D.溶液中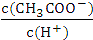 减小
减小(3)常温下将0.15mol•L-1的稀硫酸V1mL与0.1mol•L-1的NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积的变化忽略不计).
(4)常温下,浓度均为0.1mol•L-1的下列五种溶液的pH如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCNB.HClO C.H2CO3D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.NaHCO3+HCN=NaCN+H2O+CO2↑
(5)几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
20.现对①纯碱;②生石灰;③甲烷;④烧碱;⑤酒精;⑥液氧;⑦干冰;⑧碳酸氢铵;⑨水银等物质进行分类,下列分类正确的是( )
| A. | 单质:⑥⑦ | B. | 氧化物:②⑨ | C. | 碱:①④ | D. | 有机物:③⑤ |
10.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )


| A. | 石墨和金刚石的转化是物理变化 | |
| B. | 金刚石的稳定性强于石墨 | |
| C. | 石墨和金刚石是同分异构体 | |
| D. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 |
14.在298K时,实验测得溶液中的反应H2O2+2HI═2H2O+I2在不同浓度时的化学反应速率见表:
反应H2O2+2HI═2H2O+I2在不同浓度时的化学反应速率
(1)请找出化学反应速率与H2O2浓度及HI浓度之间的关系,相应的数学表达式为Kc(HI)c(H2O2),
(2)上式表达式中κ称为速率常数,通常情况下,κ越大,反应进行的越快.
反应H2O2+2HI═2H2O+I2在不同浓度时的化学反应速率
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| c(HI)/mol•L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c(H2O2)/mol•L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| ν(HI)/mol•L-1•s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
(2)上式表达式中κ称为速率常数,通常情况下,κ越大,反应进行的越快.
15.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,22g CO2含有原子数1.5NA | |
| C. | 32g 氧气和臭氧的混合气体中含有氧原子的个数为2NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA |
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: