题目内容
8.甲是一种可用于净水和净化食盐水的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是有由A、B形成的10电子阳离子,A元素原子核内质子数比E的少1,D、E处于同主族.某同学为探究甲的组成进行如下实验:
①取mg甲的晶体溶于蒸馏水,配成500mL溶液;
②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀的物质的量与滴入Ba(OH)2溶液体积的关系如图所示

③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,然后折算成标准状况下的体积为224mL
回答下列问题:
(1)D在元素周期中的位置为第三周期VIA族
(2)经测定甲的摩尔质量为453g•mol-1,其中阳离子和阴离子物质的量之比为1:1,且1mol甲含有12mol结晶水,则晶体甲的化学式为NH4Al(SO4)2•12H2O
(3)图象中V(oa):V(ab):V(bc)=3:1:2
(4)写出ab段发生反应的离子方程式:2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3.H2O
(5)配成的甲溶液物质的量浓度是0.5mol/L.
分析 甲由A、B、C、D、E五种短周期元素组成的一种盐,②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀开始增大,后沉淀减小,但沉淀最终不完全消失,则甲溶液肯定含有SO42-、Al3+,③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,则甲溶液中含有NH4+,甲溶于电离处于三种离子,A、B形成的10电子阳离子为NH4+,D、E同主族,二者应形成SO42-,且A元素原子核内质子数比E的少l,则A为N元素、E为O元素、D为S元素、B为H元素、C为Al.(2)中经测定晶体甲的摩尔质量为453g.mol-1,且1mol甲晶体中含有12mol结晶水,所以阳离子和阴离子的分子量为:453-216=237,阳离子和阴离子物质的量之比1:1,根据电中性原理,其化学式为:NH4Al(SO4)2•12H2O,oa段发生反应:2NH4Al(SO4)2+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓+(NH4)2SO4,ab段发生反应:(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3.H2O,bc段发生反应:OH-+Al(OH)3=AlO2-+2H2O,以此解答该题.
解答 解:甲由A、B、C、D、E五种短周期元素组成的一种盐,②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀开始增大,后沉淀减小,但沉淀最终不完全消失,则甲溶液肯定含有SO42-、Al3+,③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,则甲溶液中含有NH4+,甲溶于电离处于三种离子,A、B形成的10电子阳离子为NH4+,D、E同主族,二者应形成SO42-,且A元素原子核内质子数比E的少l,则A为N元素、E为O元素、D为S元素、B为H元素、C为Al.(2)中经测定晶体甲的摩尔质量为453g.mol-1,且1mol甲晶体中含有12mol结晶水,所以阳离子和阴离子的分子量为:453-216=237,阳离子和阴离子物质的量之比1:1,根据电中性原理,其化学式为:NH4Al(SO4)2•12H2O.oa段发生反应:2NH4Al(SO4)2+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓+(NH4)2SO4,ab段发生反应:(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3.H2O,bc段发生反应:OH-+Al(OH)3=AlO2-+2H2O.
(1)D为S元素,处于周期表中第三周期VIA族,故答案为:第三周期VIA族;
(2)由上述分析可知,甲的化学式为:NH4Al(SO4)2•12H2O,故答案为:NH4Al(SO4)2•12H2O;
(3)假设NH4Al(SO4)2•12H2O为2mol,oa段发生反应:2NH4Al(SO4)2+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓+(NH4)2SO4,消耗3molBa(OH)2,生成1mol(NH4)2SO4,生成2molAl(OH)3,ab段发生反应:(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3.H2O,1mol(NH4)2SO4消耗1molBa(OH)2,bc段发生反应:OH-+Al(OH)3=AlO2-+2H2O,2molAl(OH)3消耗2molBa(OH)2,故图象中V(Oa):V(ab):V(bc)=3mol:1mol:2mol=3:1:2,
故答案为:3:1:2;
(4)ab段发生反应:(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3.H2O,离子方程式为:2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3.H2O,
故答案为:2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3.H2O;
(5)实验③中取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的氨气为$\frac{0.224L}{22.4L/mol}$=0.01mol,则NH4Al(SO4)2为0.01mol,故溶液浓度为$\frac{0.01mol}{0.02L}$=0.5mol/L,
故答案为:0.5mol/L.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析、计算能力的考查,关键是根据实验现象推断含有的微粒,明确各阶段发生的反应,是对学生综合能力的考查,难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 纯水的导电性很差,所以水不是电解质 | |
| B. | SO3水溶液的导电性很好,所以SO3是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | Na2O液态时能导电,所以Na2O是电解质 |
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100mL 3mol•L-1的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(2)常温下,向一定体积的0.1mol•L-1的醋酸溶液中加水稀释后,下列说法正确的是CD.
A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中
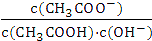 不变 D.溶液中
不变 D.溶液中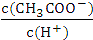 减小
减小(3)常温下将0.15mol•L-1的稀硫酸V1mL与0.1mol•L-1的NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积的变化忽略不计).
(4)常温下,浓度均为0.1mol•L-1的下列五种溶液的pH如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCNB.HClO C.H2CO3D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.NaHCO3+HCN=NaCN+H2O+CO2↑
(5)几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
| A. | 烷烃不能发生加成反应,烯烃不能发生取代反应 | |
| B. | 烷烃中含饱和键、烯烃、炔烃中含不饱和键 | |
| C. | 能发生加成反应的一定是烯烃 | |
| D. | 符合通式CnH2n+2的一定是烷烃,符合通式CnH2n的一定是烯烃. |
| A. | 单质:⑥⑦ | B. | 氧化物:②⑨ | C. | 碱:①④ | D. | 有机物:③⑤ |
| A. | 0.1molZn与含0.1molHCl的盐酸充分反应,转移的电子数目为0.2NA | |
| B. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| C. | 1molNa2O2与足量CO2充分反应转移的电子数为2NA | |
| D. | 向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移的电子的数目为NA |
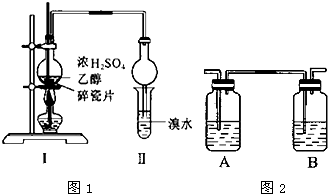 l,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷.
l,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷.