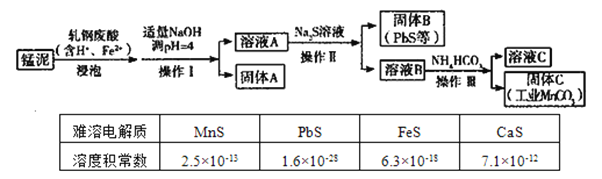
题目内容
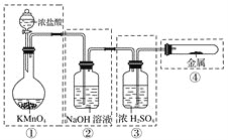
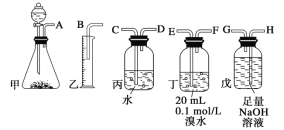
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
(1)电石制备的乙炔气体方程式______________________________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是________________(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用__________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为_________________________;
(5)若没有除H2S的装置,测定结果将会____(填“偏高”、“偏低”或“不变”) ,理由是(方程式表示)_________。
【答案】CaC2+2H2O![]() Ca(OH)2+C2H2↑ AHGEFDCB 饱和食盐水
Ca(OH)2+C2H2↑ AHGEFDCB 饱和食盐水 ![]() ×100% 偏高 H2S+Br2=S↓+2HBr
×100% 偏高 H2S+Br2=S↓+2HBr
【解析】
(1)CaC2和水反应生成氢氧化钙和乙炔;
(2)电石与足量水反应生成乙炔,其中混有的H2S可用NaOH溶液吸收,乙炔气体被溴水吸收后余下的部分通过排水法测量其体积;
(3)实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流;
(4)根据溴单质的物质的量求出消耗的乙炔的量,再根据水的体积求出乙炔的体积,然后根据乙炔求出碳化钙的量,再求质量分数;
(5)硫化氢具有还原性,能够与溴发生氧化还原反应,导致测得乙炔的物质的量偏多。
(1)CaC2和水反应生成氢氧化钙和乙炔,化学反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)电石与足量水反应生成乙炔,其中混有的杂质H2S气体可用NaOH溶液吸收,乙炔气体被溴水吸收转化为液态物质,反应后剩余的气体通过排水法测量其体积,因此正确的连接顺序为:AHGEFDCB;
(3)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用饱和食盐水代替水,通过降低水的浓度进行实验,以获得平稳的乙炔气流;
(4)乙炔分子中含有碳碳三键,通入溴水中时,乙炔与溴水恰好完全反应生成C2H2Br4,溴单质的物质的量n(Br2)=0.1mol/L×0.02L=0.002mol,其反应消耗的乙炔的物质的量为:n(C2H2)=![]() n(Br2)=0.001mol,测得排入量筒内液体体积为VmL(标况),则丙中储存的乙炔的体积为VmL,其物质的量为n=
n(Br2)=0.001mol,测得排入量筒内液体体积为VmL(标况),则丙中储存的乙炔的体积为VmL,其物质的量为n=![]() ,所以电石反应产生的乙炔的总物质的量n(C2H2)总=0.001mol+
,所以电石反应产生的乙炔的总物质的量n(C2H2)总=0.001mol+![]() ,由CaC2+2H2O→Ca(OH)2+C2H2↑可知CaC2的物质的量0.001mol+
,由CaC2+2H2O→Ca(OH)2+C2H2↑可知CaC2的物质的量0.001mol+![]() ,质量为m(CaC2)=64(0.001+
,质量为m(CaC2)=64(0.001+![]() )g;所以电石纯度可表示为
)g;所以电石纯度可表示为![]() ×100%=
×100%=![]() ×100%;
×100%;
(5)硫化氢具有还原性,能够与溴发生氧化还原反应,导致测得乙炔的物质的量偏多,最终测得电石的纯度偏高,反应的化学方程式为H2S+Br2=S↓+2HBr。