题目内容
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
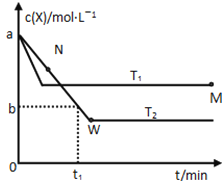
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C.M点的正反应速率υ正大于N点的逆反应速率υ逆
D.M点时再加入一定量的X,平衡后X的转化率减小
【答案】C
【解析】
A、根据图像可知W点消耗的X的物质的量大于M点消耗X的物质的量,因此根据热化学方程式可知W点放出的热量多,A不正确;B、T2下,在0~t1时间内X的浓度减少了(a-b)mol/L,则根据方程式可知Y的浓度增加了![]() mol。反应速率通常用单位时间内浓度的变化量来表示,所以Y表示的反应速率为
mol。反应速率通常用单位时间内浓度的变化量来表示,所以Y表示的反应速率为![]() mol/(L·min),B不正确;C、根据图像可知,温度为T1时反应首先达到平衡状态。温度高反应速率快,到达平衡的时间少,则温度是T1>T2。M点温度高于N点温度,且N点反应没有达到平衡状态,此时反应向正反应方向进行,即N点的逆反应速率小于N点的正反应速率,因此M点的正反应速率大于N点的逆反应速率,C正确;D、由于反应前后均是一种物质,因此M点时再加入一定量的X,则相当于是增大压强,正反应是体积减小的可逆反应,因此平衡向正反应方向移动,所以X的转化率升高,D不正确.
mol/(L·min),B不正确;C、根据图像可知,温度为T1时反应首先达到平衡状态。温度高反应速率快,到达平衡的时间少,则温度是T1>T2。M点温度高于N点温度,且N点反应没有达到平衡状态,此时反应向正反应方向进行,即N点的逆反应速率小于N点的正反应速率,因此M点的正反应速率大于N点的逆反应速率,C正确;D、由于反应前后均是一种物质,因此M点时再加入一定量的X,则相当于是增大压强,正反应是体积减小的可逆反应,因此平衡向正反应方向移动,所以X的转化率升高,D不正确.
故选C。

练习册系列答案
相关题目