题目内容
9.下列说法不正确的是( )| A. | 在化学反应进行的过程中放出或吸收的热量称为反应热 | |
| B. | 在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热 | |
| C. | 氢氧化钡晶体与氯化铵晶体混合是吸热反应 | |
| D. | 化学反应中的能量变化与参加反应的物质的量成正比 |
分析 A、化学反应过程中化学键的断裂与生成有能量变化;
B、中和热的定义是强酸稀溶液与强碱稀溶液完全反应生成1mol水放出的热量;
C、常见的吸热反应有二氧化碳与C的反应,C与高温水蒸气的反应,氯化铵与氢氧化钡的复分解反应,多数的分解反应;
D、化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比.
解答 解:A、化学反应过程中放出或吸收的热量为反应热,故A正确;
B、在稀溶液中,强酸和强碱发生中和反应而生成1 mol H2O(l)时所放出的热量为中和热,故B错误;
C、氢氧化钡晶体与氯化铵晶体混合是吸热反应,故C正确;
D、化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比,故D正确;
故选B.
点评 本题考查反应热与能量的变化,题目侧重于相关概念的理解和把握,难度不大,注意相关基础知识的理解和把握.

练习册系列答案
相关题目
19.在下列影响化学反应速率的外界因素中,肯定能增大化学反应速率的是( )
①升高温度 ②加入正催化剂 ③增加反应物的量④将固体块状反应物磨成粉末 ⑤增大压强.
①升高温度 ②加入正催化剂 ③增加反应物的量④将固体块状反应物磨成粉末 ⑤增大压强.
| A. | 只有①②④ | B. | 只有②④ | C. | 只有①②③④ | D. | 全部 |
20.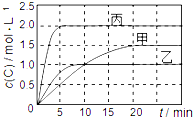 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:
下列说法正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 1L | 1L | 2L |
| 温度 | T1 | T2 | T2 |
| 反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
| A. | 由图可知:T1<T2,且该反应为吸热反应 | |
| B. | T1时该反应的平衡常数K=7.2 | |
| C. | 前10min甲、乙、丙三个容器中A的反应速率:v(A)甲<v(A)乙<v(A)丙 | |
| D. | 平衡时A的质量m:m乙<m甲<m丙 |
17.某化合物受热可完全分解,其中一种气体可使润湿的红色石蕊试纸变蓝,另一气体可澄清石灰水变浑浊.取该化合物溶于水,加入CaCl2溶液,无现象.则该化合物可能是( )
| A. | NH4HCO3 | B. | NH4Cl | C. | NH4NO3 | D. | (NH4)2CO3 |
1.下列有关反应热测定实验叙述正确的是( )
| A. | 盖斯定律为我们提供了解决很难由实验直接测定而获得反应热的理论依据 | |
| B. | 若用50mL 0.50mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.25mo1•L-1的硫酸充分反应,两反应测定的反应热不相等 | |
| C. | 实验时只需要记录反应体系的最高温度t即可 | |
| D. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,再用环形玻璃搅拌棒不断搅拌 |
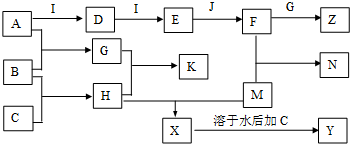
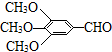 )和抗癫痫药物H(
)和抗癫痫药物H(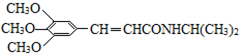 )的路线如下(部分反应略去条件和试剂):
)的路线如下(部分反应略去条件和试剂):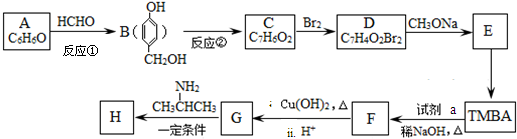
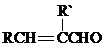 +H2O
+H2O +2Br2→
+2Br2→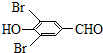 +2HBr;
+2HBr;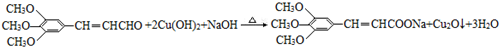 ;
;