题目内容
5.关于锌、铜和稀硫酸构成的原电池的下列说法中正确的是( )| A. | 锌是正极,铜是负极 | B. | 电子从铜片经导线流向锌片 | ||
| C. | 负极的反应式为2H++2e-=H2↑ | D. | 反应一段时间后,溶液的pH升高 |
分析 锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,铜为正极,正极上氢离子得电子发生还原反应,电子从负极流向正极,以此解答.
解答 解:A、锌比铜活泼,应为原电池的负极,发生氧化反应,铜为正极,发生还原反应,则A错误;
B、电子从负极流向正极,则电子从锌片经导线流向铜片,故B错误;
C、锌为负极,发生氧化反应,负极的反应式为Zn-2e-═Zn2+,故C错误;
D、正极上氢离子得电子发生还原反应,则氢离子浓度减小,所以反应一段时间后,溶液的pH升高,故D正确.
故选D.
点评 本题考查原电池池知识,侧重于学生的分析能力和电化学知识的综合考查,注意把握电极方程式的书写,难度不大.

练习册系列答案
相关题目
20.下列有关化学用语的表述中不正确的是( )
| A. | 1H、2H、H+都可说成是氢元素的不同微粒 | |
| B. | 16O2和18O2互为同位素,化学性质相同 | |
| C. | 铝原子的结构示意图: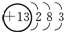 | |
| D. | 甲烷的结构式:CH4 |
17.下列化合物中阳离子半径与阴离子半径比值最小的是( )
| A. | NaF | B. | MgI2 | C. | NaI | D. | KBr |
 ;
; .
.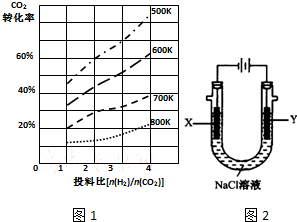 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.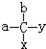 C7H16的同分异构体中具有“手性碳原子”的有2种,写出其中一种的名称3-甲基己烷(或2,3-二甲基戊烷).
C7H16的同分异构体中具有“手性碳原子”的有2种,写出其中一种的名称3-甲基己烷(或2,3-二甲基戊烷).
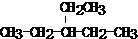
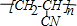 ,反应所属类型分别为加成反应、加聚反应.
,反应所属类型分别为加成反应、加聚反应.