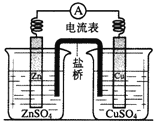
题目内容
【题目】常温下,在新制氯水中滴加NaOH溶液,溶液中水电离出来的c水(H+)与 NaOH溶液的体积之间的关系如图所示。下列推断正确的是
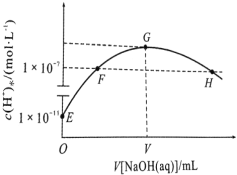
A.用 pH 试纸测定 E 点对应的溶液,其 pH=3
B.G 点对应的溶液中:c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
C.常温下加水稀释 H 点对应的溶液,溶液pH 减小
D.F、H 点对应的溶液中都存在:c(Na+) = c(Cl-) + c(ClO-)
【答案】BC
【解析】
往氯水中滴加NaOH溶液,会使平衡Cl2+H2O HCl+HClO正向移动,生成NaCl和NaClO,图中四个关键点的溶质E点为HCl和HClO,F点为NaCl、HClO和NaClO,G点为NaCl和NaClO,H点氢氧化钠过量,溶质有NaCl、NaClO和NaOH。
A.E点溶液有漂白性,不能用pH试纸测定酸碱度,故A错误;
B.G点溶液的NaCl和NaClO的量1:1,NaClO部分水解显碱性,c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+),故B正确;
C.对H点的溶液加水稀释,过量的NaOH大量存在,稀释对OH-浓度减小的影响比对NaClO水解的促进作用大,所以pH减小,故C正确;
D.分清F、H点的溶质,便可知F点溶液显中性,而H点溶液显碱性,c(Na+) =c(Cl-) + c(ClO-)只能在溶液显中性时成立,故D错误;
答案选BC。

【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
| IA | 0 | |||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | ① | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | Ar | ||||
(1)②的元素符号是_______
(2)①、⑤两种元素的原子半径大小关系:①__⑤(填“>”或“<”);
(3)③、④和⑤中,金属性最强的元素是____(填元素符号);
(4)⑤、⑥的最高价氧化物对应的水化物相互反应的离子方程式:____________。
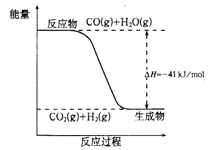
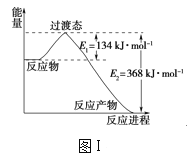
【题目】(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:__。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知:③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式为__。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ·mol-1) | a | b | c | x |
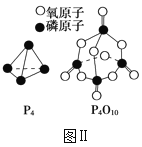
已知1molP4(g)完全燃烧生成P4O10(g)放出的热量为dkJ,P4和P4O10的结构如图Ⅱ所示,则上表中x=___(用含有a、b、c、d的代数式表示)。