题目内容
【题目】某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
(1)在一个质量为a g的蒸发皿中加入一些样品,称得总质量为b g。用酒精灯对其充分加热,冷却后称得其总质量为c g。残留在蒸发皿中的固体是(填化学式)_______________。
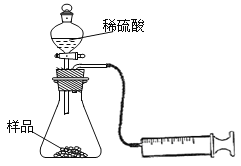
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。为了保证实验成功,所选用针筒的最大刻度值应大于或等于__________(mL)。(设实验在标准状况下进行)
(3)打开活塞逐滴加入稀硫酸,至没有气泡产生为止。针筒中收集到气体折算成标准状况下的体积为V mL(滴入稀硫酸的体积及针筒活塞的内壁的摩擦力忽略不计)。该科研小组设称取的每份样品中的Na2CO3、NaHCO3的物质的量分别为x、y,且没有利用化学方程式进行计算,就列出了如下算式:x + y = VmL/22400 mL·mol-1,他们依据的原理是___________。根据相似原理,请完成下列算式:2x + y =___________由上述两算式,该科研小组通过计算,得出了样品中的Na2CO3、NaHCO3的质量分数。
【答案】Na2CO3 (![]() +
+![]() )×22400 原子守恒
)×22400 原子守恒 ![]() ×2
×2
【解析】
(1)NaHCO3受热会发生如下反应:2NaHCO3![]() Na2CO3+CO2↑+ H2O,其中CO2气体,水都和离开反应体系,只剩下Na2CO3固体,则残留在蒸发皿中的固体是Na2CO3;
Na2CO3+CO2↑+ H2O,其中CO2气体,水都和离开反应体系,只剩下Na2CO3固体,则残留在蒸发皿中的固体是Na2CO3;
(2) 由(1)可知冷却后的总质量其实就是Na2CO3和蒸发皿质量,所以(c-a)就是Na2CO3质量,根据碳原子守恒,放出的CO2的物质的量为(c-a)÷106moL,在一个质量为a g的蒸发皿中加入一些样品,称得总质量为b g,用酒精灯对其充分加热,冷却后称得其总质量为c g,则(b-c)g是失去水和CO2的总质量,根据化学反应2NaHCO3![]() Na2CO3+CO2↑+H2O,水是液体,则CO2的物质的量为(b-c)÷62mol,所以所选用针筒的最大刻度值应大于或等于(
Na2CO3+CO2↑+H2O,水是液体,则CO2的物质的量为(b-c)÷62mol,所以所选用针筒的最大刻度值应大于或等于(![]() +
+![]() )×22400 mL;
)×22400 mL;
(3)根据题给方程可知,他们依据的原理是原子守恒;根据Na原子守恒可列方程2x+y=残留在蒸发皿中的固体中的Na,而固体质量为(c-a)g,钠原子的物质的量为(c-a)÷106×2,所以2x + y =![]() ×2。
×2。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作和现象 | 结论 |
A | 向NaBr溶液中分别滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | Br-的还原性强于Cl- |
B | 相同条件下,分别向20 mL 0.01 mol·L-1 KMnO4溶液和20 mL 0.05 mol·L-1 KMnO4溶液中滴加相同浓度和体积的草酸溶液(过量),0.05 mol·L-1的KMnO4溶液紫色褪色的时间更短(生成的Mn2+对该反应无影响) | 浓度对反应速率的影响:浓度越大,反应速率越快 |
C | 向淀粉碘化钾溶液中通入过量氯气,溶液由无色变为蓝色,后蓝色褪去 | 氯气具有强氧化性和漂白性 |
D | 室温下,用pH试纸测得0.1 mol·L-1 Na2SO3溶液的pH约为10,0.1 mol·L-1 NaHSO3溶液的pH约为5 | HS |
A.AB.BC.CD.D