题目内容
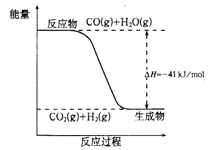
【题目】(1)化学反应过程中,不仅有物质的变化,还伴随有能量的变化。根据下图写出反应的热化学方程式__________。
(2)化学反应速率和化学平衡是化学反应原理的重要组成部分。将4.0 molPCl3和2.0 molCl2充入10L恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g) ![]() PCl5(g),经2 min达到平衡时,PCl5为0.40 mol。
PCl5(g),经2 min达到平衡时,PCl5为0.40 mol。
①在0~2min内,用Cl2表示的反应速率为:![]() (Cl2) =_____mol/(L·min) ;
(Cl2) =_____mol/(L·min) ;
②达到平衡时,PCl3的转化率为________;
③如果再通入1.0 molCl2,相同温度下重新达到平衡时,PCl5的物质的量________。(填字母代号)
A.增大 B.减小 C.不变
(3)水的电离与溶液的酸碱性密切相关。
①常温下,某柠檬水溶液的pH=3,其中的c(OH-)=______mol/L;
②常温下,浓度均为0.1mol/L的CH3COOH溶液和CH3COONa溶液中,水的电离程度大小关系是:前者____后者(填“大于”、“小于”或“等于”);
③常温下,浓度均为0.1mol/L的NaX和NaY两种盐溶液,其pH分别为8和10,则HX和HY的酸性强弱关系是:HX____HY(填“>”或“<”)。
(4)研究化学能与电能相互转化的装置、过程和效率的科学,叫做电化学。
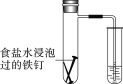
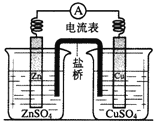
①某原电池装置如图,则该原电池的负极是____(填“Zn”或“Cu”),正极的电极反应式为_______;
②用铂电极电解某金属氯化物(XCl2)的溶液,当收集到2.24L Cl2(标准状况)时,阴极增重6.4g,则该金属的相对原子质量为________。
【答案】CO(g)+H2O(g)=CO2(g)+H2(g) H=-41kJ/mol 0.02 ![]() A
A ![]() 小于 > Zn Cu2++2e=Cu 64
小于 > Zn Cu2++2e=Cu 64
【解析】
(1)由图可知,该反应为放热反应,其热化学反应方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) H=-41kJ/mol;
(2)①根据信息可知,反应生成了0.4molPCl5,根据化学方程式可知消耗了0.40molCl2,则v(Cl2)= ;故答案为:0.02;
;故答案为:0.02;
②根据信息可知,反应生成了0.4molPCl5,根据化学方程式可知消耗PCl3的物质的量为0.40mol,则其转化率为![]() ;故答案为:
;故答案为:![]() ;
;
③如果再加入1.0mol氯气,反应正向移动,再次平衡时,PCl5的物质的量增大,选A,故答案为:A;
(3)①常温下,某柠檬水溶液的pH=3,c(H+)=10-3mol/L,c(OH)=![]() ;故答案为:
;故答案为:![]() ;
;
②醋酸抑制水的电离,醋酸钠水解促进水的电离,则水的电离程度大小关系是:前者<后者;故答案为:小于;
③由盐溶液的pH分别为8和10,可知NaY水解程度大,对应HY的酸性弱,则HX和HY的酸性强弱关系是:HX>HY,故答案为:>;
(4)①由原电池装置可知,该原电池的负极是Zn,正极为Cu,负极电极反应为:Zn-2e-=Zn2+,正极的电极反应为Cu2++2e=Cu;故答案为:Zn;Cu2++2e=Cu;
②设该金属的相对原子质量为x,当收集到2.24LCl2(标准状况)时,阴极增重6.4g,由电子守恒可知,![]() ,解得:x=64,故答案为:64。
,解得:x=64,故答案为:64。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作和现象 | 结论 |
A | 向NaBr溶液中分别滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | Br-的还原性强于Cl- |
B | 相同条件下,分别向20 mL 0.01 mol·L-1 KMnO4溶液和20 mL 0.05 mol·L-1 KMnO4溶液中滴加相同浓度和体积的草酸溶液(过量),0.05 mol·L-1的KMnO4溶液紫色褪色的时间更短(生成的Mn2+对该反应无影响) | 浓度对反应速率的影响:浓度越大,反应速率越快 |
C | 向淀粉碘化钾溶液中通入过量氯气,溶液由无色变为蓝色,后蓝色褪去 | 氯气具有强氧化性和漂白性 |
D | 室温下,用pH试纸测得0.1 mol·L-1 Na2SO3溶液的pH约为10,0.1 mol·L-1 NaHSO3溶液的pH约为5 | HS |
A.AB.BC.CD.D