题目内容
19.在短周期主族元素中,甲元素的原子半径最小;乙元素是地壳中含量最多的金属元素;丙元素的次外层电子数是最外层电子数的4倍;丁元素的最高价氧化物的水化物和它的氢化物反应生成盐A.则:(1)甲是H,乙是Al,丙是Mg,丁是N.
(2)盐A属于离子化合物(填“离子”或“共价”).
分析 在短周期主族元素中,甲元素的原子半径最小,则甲为H,乙元素是地壳中含量最多的金属元素,则乙为Al,丙元素的次外层电子数是最外层电子数的4倍,则丙为Mg,丁元素的最高价氧化物的水化物和它的氢化物反应生成盐A,则丁为N,A为NH4NO3,据此答题.
解答 解:在短周期主族元素中,甲元素的原子半径最小,则甲为H,乙元素是地壳中含量最多的金属元素,则乙为Al,丙元素的次外层电子数是最外层电子数的4倍,则丙为Mg,丁元素的最高价氧化物的水化物和它的氢化物反应生成盐A,则丁为N,A为NH4NO3,
(1)根据上面的分析可知,甲为H,乙为Al,丙为Mg,丁为N,故答案为:H;Al;Mg;N;
(2)根据上面的分析可知,A为NH4NO3,属于离子化合物,故答案为:离子.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重考查学生分析推理能力,注意对元素周期律的理解掌握,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列关于物质性质的比较,不正确的是( )
| A. | 金属性强弱:Na>Mg>Al | B. | 酸性强弱:HIO4>HBrO4>HClO4 | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 原子半径大小:Na>S>O |
4.下列离子方程式正确的是( )
| A. | 等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生:Cu 2++2Br- $\frac{\underline{\;电解\;}}{\;}$Cu+Br2 | |
| B. | Na2S溶液水解:S2-+2H2O?H2S+2OH- | |
| C. | Fe(NO3)3的酸性溶液中通入足量硫化氢:2Fe3++H2S=2Fe2++S↓+2H+ | |
| D. | H218O中投入Na2O2:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
11.100mL 6mol/LH2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | 碳酸钠(s) | B. | 醋酸钠(s) | C. | 硫酸钠(aq) | D. | 硫酸钾(s) |
8.下列关于合金的说法错误的是( )
| A. | 合金是由两种或两种以上的金属与非金属经一定方法所合成的具有金属特性的物质 | |
| B. | 镁铝合金的熔点比镁和铝都髙 | |
| C. | 在合金中加入适量的稀土金属能大大改善其性能 | |
| D. | 青铜、硬铝、钢都是合金 |
9.下列说法或表示方法不正确的是( )
| A. | 若形成化学键释放的能量大于断裂化学键所吸收的能量,则是放热反应 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由4P(s,红磷)═P4(s,白磷)△H=+139.2 kJ/mol,可知红磷比白磷稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式可表示为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |

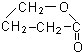 +2H2O.
+2H2O.