题目内容
9.实验室里常利用反应:3Cu+8HNO3(稀)$\frac{\underline{\;\;△\;\;}}{\;}$3Cu(NO3)2+2NO↑+4H2O来制取NO,当有400mL,2mol•L-1的稀硝酸参加反应时,计算:(1)参加反应的铜的质量是多少?
(2)能生成多少升NO(标准状况下)?
(3)被还原的HNO3的物质的量为多少?
分析 (1)根据方程式结合硝酸的物质的量计算参加反应的铜的物质的量,进而计算其质量;
(2)根据方程式结合硝酸的物质的量计算生成一氧化氮的物质的量;
(3)被还原硝酸生成NO,根据N原子守恒计算被还原硝酸的物质的量.
解答 解:n(HNO3)=C×V=0.4L×2 mol•L-1=0.8mol,设消耗铜的质量是m,生成一氧化氮的体积是V,
3Cu+8HNO3(稀)$\frac{\underline{\;\;△\;\;}}{\;}$3Cu(NO3)2+2NO↑+4H2O
3×64g 8mol 2×22.4L
m(Cu) 0.8mol V(NO)
(1)$\frac{3×64}{m}=\frac{8}{0.8}$,m(Cu)=19.2g,参加反应的铜的质量是19.2g,答:参加反应的铜的质量是19.2g;
(2)$\frac{8}{0.8}=\frac{2×22.4}{V}$,V(NO)=4.48L,答:能生成4.48升NO(标准状况下);
(3)在该反应中,被还原的硝酸占总反应硝酸的比重为$\frac{1}{4}$,故被还原的硝酸的物质的量为:0.8mol×$\frac{1}{4}$=0.2mol,答:被还原的HNO3的物质的量为0.2mol.
点评 本题考查化学方程式有关计算,比较据此,侧重对基础知识的巩固,注意反应中硝酸的作用是解题的关键.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
4.下列关于钠的氧化物(Na2O2、Na2O)的叙述正确的是( )
| A. | Na2O是白色固体,和冷水作用得到O2和NaOH | |
| B. | Na2O2与水的反应中,Na2O2既是氧化剂,又是还原剂 | |
| C. | Na2O2中氧的化合价是-1价 | |
| D. | 都能与酸反应,生成盐和水,都是碱性氧化物 |
5.甲、乙两元素原子的第2层电子数都是其他层电子总数的2倍.如果甲的原子序数比乙小,则下列推断正确的是( )
| A. | 甲和乙分别是C和Mg | |
| B. | 乙元素形成的某种单质可能是天然物质中硬度最大的 | |
| C. | 甲与乙处于同一主族 | |
| D. | 乙元素的单质与冷水反应很快而遇热水则发生爆炸 |
2.下列有关化学电源的叙述错误的是( )
| A. | 太阳能电池是将太阳能转化为电能的一种装置 | |
| B. | 碱性锌锰电池的放电时间比酸性锌锰电池的放电时间更持久 | |
| C. | 氢氧燃料电池的负极材料不参加电极反应 | |
| D. | 铅蓄电池中的电解质是98%的硫酸 |
14.决定一定物质的量气体体积大小的主要因素是( )
| A. | 气体分子的大小 | B. | 气体分子的质量 | ||
| C. | 气体分子间距离的大小 | D. | 气体分子的组成 |
18.下列说法正确的是( )
| A. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 | |
| B. | 用溴水鉴别苯和正己烷 | |
| C. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| D. | 乙烯和苯都能使溴水褪色,褪色的原因不相同 |
 .
.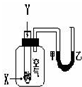 某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降、乙处升.关于该反应的下列叙述:其中正确的是( )
某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降、乙处升.关于该反应的下列叙述:其中正确的是( )