题目内容
6.已知A,B,C,D,E,F为原子序数依次增大的前四期元素,A与D,C与E同主族.B元素的原子价电子排布为msnmpn,C元素的最外层电子数是其电子层数的3倍.A与C,D与C均可形成原子个数比为1:1或2:1的化合物.F元素原子的M电子层有5对成对电子.回答下列问题:(1)A与C可形成的原子个数比为1:1的化合物,写出其电子式
 ,E原子的价电子排布式为3s23p5,F在周期表中的位置是第四周期第IVB族.
,E原子的价电子排布式为3s23p5,F在周期表中的位置是第四周期第IVB族.(2)A与B形成的化合物B2A2分子中含有3σ键、2个π键,B原子的杂化方式为sp.
(3)C与E能形成两种化合物EC2、EC3,其立体构型分别为V形、平面三角形.
分析 B元素的原子价电子排布为msnmpn,n为2,所以价电子排布为2s22p2,为C元素;
C元素的最外层电子数是其电子层数的3倍,所以C为O元素;
A与C,D与C能形成原子个数比分别为1:1和2:1的化合物,那么A为H元素,D为Na元素;C与E同主族,那么E为S元素;
F元素原子的M电子层有5对成对电子,即M层上有10个电子,那么原子序数为22,即为Cr元素,
(1)双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;Cl最外层有7个电子,位于第三周期;F为Cr,是22号元素,据此解答即可;
(2)H与C形成的B2A2为乙炔,内含2个C-H键,1个C≡C键,据此解答即可;
(3)根据价层电子对互斥理论确定分子空间构型.
解答 解:B元素的原子价电子排布为msnmpn,n为2,所以价电子排布为2s22p2,为C元素;
C元素的最外层电子数是其电子层数的3倍,所以C为O元素;
A与C,D与C能形成原子个数比分别为1:1和2:1的化合物,那么A为H元素,D为Na元素;
F元素原子的M电子层有5对成对电子,即M层上有10个电子,那么原子序数为22,即为Cr元素,
(1)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,Cl最外层有7个电子,位于第三周期,则Cl原子的价电子排布式为3s23p5;Cr为22号元素,处于第四周期第IVB族,故答案为:
,Cl最外层有7个电子,位于第三周期,则Cl原子的价电子排布式为3s23p5;Cr为22号元素,处于第四周期第IVB族,故答案为: ;3s23p5;第四周期第IVB族;
;3s23p5;第四周期第IVB族;
(2)乙炔中含有2个C-H共价键,1个C≡C键,故总共有3个σ键,2个π键,B原子的杂化方式为sp,故答案为:3;2;sp;
(3)二氧化硫分子中价层电子对个数=2+$\frac{1}{2}$(6-2×2)=3且含有一个孤电子对,所以为V形结构,SO3中S原子的价层电子对为$\frac{6}{2}$=3,VSEPR模型为平面三角形,S原子没有孤对电子对,分子为平面三角形,故答案为:V形;平面三角形.
点评 本题考查了元素的推断、电子式的书写、化学键的判断、分子的空间构型等知识点,根据价层电子对互斥理论确定微粒空间构型,题目难度不大.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案| A. | 使用的NaOH固体在空气中敞口放置了一段时间 | |
| B. | 容量瓶用蒸馏水洗净后,未经干燥 | |
| C. | 在烧杯中溶解NaOH后,未经冷却即将溶液转入容量瓶 | |
| D. | 调节天平零点时未将游码回到最左边 |
| A. | 原电池是化学能转化成电能的装置 | |
| B. | 化学键断裂时吸收能量,形成时放出能量 | |
| C. | 化学反应中吸热反应时△H>0,放热反应时△H<0 | |
| D. | 标准状况下,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量为该物质的燃烧 |
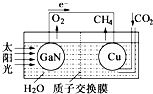 科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.以下说法错误的是( )
| A. | 铜电极表面的电极反应式 CO2+8e-+8H+=CH4+2H2O | |
| B. | 为提高该人工光合系统的工作效率,可向装置中加入少量硫酸 | |
| C. | 该装置仅将化学能转变为电能 | |
| D. | 装置中的H+由左向右移动 |
