题目内容
【题目】按下图装置进行实验,并回答下列问题:
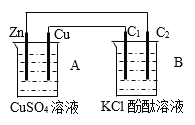
(1)判断装置的名称:A池为__________________;B池为________________;
(2)锌极为___________极,电极反应式__________;
(3)石墨棒C1为________极,电极反应式为_____;石墨棒C2附近发生的实验现象为_____;
【答案】原电池 电解池 负 Zn - 2e- = Zn2+ 阳 2Cl- - 2e- = Cl2↑ 无色溶液变红色
【解析】
(1)原电池两个电极不能相同;电解池中两个电极可以相同也可以不同;
(2)原电池中活泼性强的电极为负极;负极失电子发生氧化反应;
(3)B是电解池,石墨棒C1与原电池正极相连,C1为阳极,氯离子在阳极失电子发生氧化反应;石墨棒C2与原电池负极相连,C2为阴极,氢离子得电子生成氢气,氢氧根离子浓度增大。
(1)A池中两个电极活泼性不同,A是原电池;B池中两个电极相同,B是电解池;
(2)A池中锌的活泼性大于铜,锌极为负极,负极失电子发生氧化反应,负极反应式为Zn - 2e- = Zn2+;
(3)B是电解池,石墨棒C1与原电池正极相连,C1为阳极,氯离子在阳极失电子发生氧化反应,电极反应式是2Cl- - 2e- = Cl2↑;石墨棒C2与原电池负极相连,C2为阴极,水电离的氢离子得电子生成氢气,电极反应式是2H++2e-=H2↑,石墨棒C2附近水的电离平衡正向移动,H+继续放电,OH-浓度比H+浓度大,溶液呈碱性,实验现象为无色溶液变红色。

【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积/mL | 浓度(mol/L) | 体积/mL | ||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4)∶n(KMnO4) ______________。
(2)探究温度对化学反应速率影响的实验编号是_______ (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 ________.
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______。