题目内容
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究新的热点。 完成下列问题:
(1)CO2催化加氢合成CH3OCH3是一种CO2转化方法,其过程中主要发生下列反应:
反应I:![]()
反应Ⅱ:![]()
①写出CO和H2合成CH3OCH3的热化学方程式____。
②分别在2L恒温密闭容器甲(恒温恒容)、乙(恒温恒压)中,加入CO2和H2各1 mol的混合气体,假设只发生反应Ⅱ,则两容器中反应达平衡后放出或吸收的热量较多的是____(填“甲”或“乙”)。当反应5 min时,测得甲容器中压强变为原来的一半,则用CO2表示的反应的速率= ___。
③在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

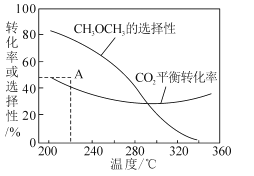
i)温度高于300℃,温度对CO2平衡转化率影响较大的是反应____(填“I”或“Ⅱ”)。
ii)220℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施可以是____(任答一条)。
(2)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为____(写离子符号);若所得溶液c(HCO3-):c(CO32-)=1:5,溶液pH= ___。(室温下,H2CO3的![]() )
)
【答案】![]() 乙 0.05mol/(L·min) Ⅰ 增大压强或使用对反应Ⅱ催化活性更高的催化剂或其他合理答案 CO32- 11
乙 0.05mol/(L·min) Ⅰ 增大压强或使用对反应Ⅱ催化活性更高的催化剂或其他合理答案 CO32- 11
【解析】
(1)①先写出CO和H2反应的方程式,该反应方程式为2CO+4H2=CH3OCH3+H2O,然后根据盖斯定律进行分析;
②根据方程式的特点和压强对化学平衡的影响分析;压强变为一半,在相同的条件下,压强之比等于物质的量之比,即气体物质的量变为原来的一半,然后进行分析;
③i)根据图像,温度高于300℃时,CH3OCH3的选择性迅速降低,而CO2的平衡转化率增大,据此分析;
ii)增大CH3OCH3选择性,即增大CH3OCH3的物质的量,不改变反应时间和温度,反应向正反应方向进行或加快反应速率,据此分析;
(2)CO2与NaOH反应,产物可能是Na2CO3,也可能是NaHCO3,也可能是两者的混合物,需要根据碳酸的二级电离平衡常数进行分析和对比;
(1) ①CO和H2反应的方程式为2CO+4H2=CH3OCH3+H2O,根据盖斯定律,将反应II-2×反应I,2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) △H=-204.9kJ·mol-1;
②反应II是气体物质的量减小的反应,随着反应的进行,恒温恒容容器内的气体压强减小,恒温恒压相当于在恒温恒容基础上增大压强,增大压强,该反应向正反应方向进行,放出的热量增多,即乙容器放出的热量较多;甲容器为恒温恒容,5min时甲容器内的压强变为原来的一半,则气体物质的量变为原来的一半,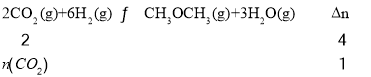 ,解得n(CO2)=0.5mol,根据化学反应速率的表达式为υ(CO2)=
,解得n(CO2)=0.5mol,根据化学反应速率的表达式为υ(CO2)=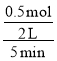 =0.05mol/(L·min);
=0.05mol/(L·min);
③i)根据图像,温度高于300℃时,CH3OCH3的选择性迅速降低,反应II向逆反应方向进行,CO2的转化率降低;反应I是吸热反应,升高温度,平衡向正反应方向反应,CO2的转化率增大,根据图像,温度高于300℃时,CO2的平衡转化率增大,说明温度对CO2平衡转化率影响较大的是反应I;
ii)在不改变时间和温度情况下,一定能提高CH3OCH3选择性措施的是增大压强或使用对反应II催化活性更高的催化剂;
(2)Ka2=![]() ,所得溶液的pH=13,即c(H+)=10-13mol·L-1,
,所得溶液的pH=13,即c(H+)=10-13mol·L-1, ![]() =5×10-11,
=5×10-11,![]() =500,c(CO32-)>c(HCO3-),CO2主要转化为CO32-;所得溶液c(HCO3-):c(CO32-)=1:5,代入Ka2=
=500,c(CO32-)>c(HCO3-),CO2主要转化为CO32-;所得溶液c(HCO3-):c(CO32-)=1:5,代入Ka2=![]() =5×10-11,
=5×10-11,![]() =5×10-11,c(H+)=1×10-11mol·L-1,即此时溶液的pH=11。
=5×10-11,c(H+)=1×10-11mol·L-1,即此时溶液的pH=11。