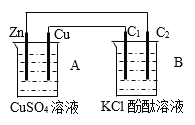
题目内容
【题目】水的电离常数如下图中a、b两条曲线所示,曲线中的点都符合c(H+)×c(OH-)=常数。下列说法正确的是
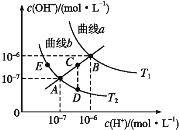
A. 图中温度T2>T1
B. 曲线a、b均代表纯水的电离情况
C. 图中五点的KW的关系:B>C>A>D=E
D. 若处在B点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液呈碱性
【答案】D
【解析】
A、水的电离是吸热过程,升高温度促进水电离,则水中c(H+)、c(OH-)及离子积常数增大,根据图像可知,T1曲线所示水的离子积常数大于T2,所以T1>T2,故A错误;B、只有c(OH-)=c(H+)的点是纯水的电离,所以只有A、B点才是纯水的电离,故B错误;C、水的离子积常数只与温度有关,温度越高,离子积常数越大,同一曲线对应相同温度,根据图像可知,温度高低点顺序是B>C>A=D=E,所以离子积常数大小顺序是B>C>A=D=E,故C错误;D、B点时,KW=1×10-12,pH=2的硫酸中c(H+)=0.01 mol·L-1,pH=12的KOH溶液中c(OH-)=1 mol·L-1,两溶液等体积混合时剩余碱,溶液呈碱性,D正确。

【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJ/mol]:下列说法正确的是( )
2NH3(g)△H=﹣92.4kJ/mol]:下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A. 2c1>c3 B. a+b>92.4 C. 2p2<p3 D. α1+α3<1
【题目】在2L的密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K300℃>K350℃,则该反应正反应是_______热反应。
(2)如图表示NO2的变化的曲线是_________。用O2表示从0~2 s内该反应的平均速率v=_______ mol·L-1·s-1。
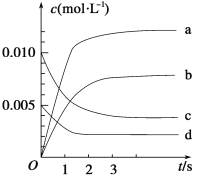
(3)能说明该反应已达到平衡状态的是____。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是____。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂