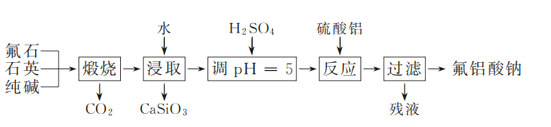
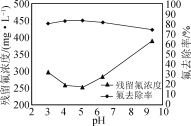
题目内容
【题目】对反应:![]()
(1)配平上述化学方程式并标出该反应中电子转移情况_____________________________
(2)该反应中的氧化剂是__________ ,被氧化的元素是_____________。
(3)1 mol Cl2参加反应,被氧化的NH3 的物质的量是_____________mol。
(4)若有68g NH3参加反应,电子转移的物质的量是_______mol。
【答案】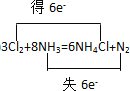 (单线桥也可以) Cl2 N
(单线桥也可以) Cl2 N ![]() 3
3
【解析】
(1)在该反应中,氯元素的化合价由0价变为-1价,氮元素的化合价由-3价变为0价,根据电子得失守恒和质量守恒得:3Cl2+8NH3═6NH4Cl+N2;用双线桥标出电子转移的方向和数目可为: (单线桥也可以);
(单线桥也可以);
(2)根据化合价变化知,氯气是氧化剂,氨气中氮元素被氧化;
(3)根据方程式知,该反应中有![]() 的氨气被氧化,则1mol Cl2参加反应,被氧化的NH3 的物质的量是
的氨气被氧化,则1mol Cl2参加反应,被氧化的NH3 的物质的量是![]() ;
;
(4)根据方程式知,该反应中有![]() 的氨气被氧化,若有68g NH3参加反应,电子转移的物质的量是68g÷17g·mol-1×
的氨气被氧化,若有68g NH3参加反应,电子转移的物质的量是68g÷17g·mol-1×![]() ×(3-0)=3mol;
×(3-0)=3mol;

 阅读快车系列答案
阅读快车系列答案【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
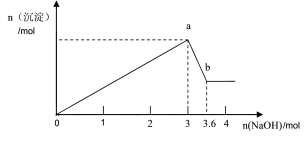
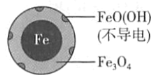
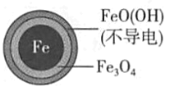
(1)Fe还原水体中NO3-的反应原理如图所示。
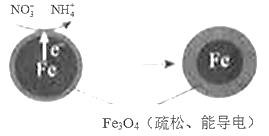
①作负极的物质是____。
②正极的电极反应式是____。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是____。
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:____。
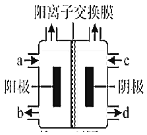
【题目】(一)工业上,在Cu2O/ZnO 作催化剂的条件下发生反应:CO(g)+2H2(g)CH3OH(g) △H
(1)已知:CH3OH(l)=CH3OH(g) △H=+35.2kJmol-1,根据表:
物质 | H2(g) | CO(g) | CH3OH(l) |
燃烧热/kJmol-1 | -285.8 | -283.0 | -726.5 |
反应CO(g)+2H2(g)CH3OH(g) △H=______kJmol-1
(2)向2L恒容密闭容器中通入1mol CO(g)和2mol H2(g),发生反应合成甲醇,反应过程中n(CH3OH)与时间(t)及温度的关系如图1所示。在500℃恒压条件下,请在图1中画出反应体系中n(CH3OH)与时间(t)变化总趋势图。
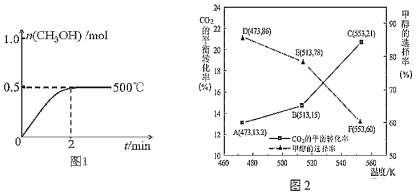 ____________
____________
(二)甲醇还可用CO2与H2在催化剂CZZA(普通铜基催化剂)作用下合成,相关反应如下:
反应ⅠCO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=-49.2kJmol-1
反应ⅡCO2(g)+H2(g)CO(g)+H2O(g) △H2=41.2kJmol-1
(3)以CZZA/rGO为催化剂,在一定条件下,将1mol CO2与3mol H2通入恒容密闭容器中进行反应I和反应II,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图2所示:
①在553K时,反应体系内CO的物质的量为______ mol
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因:______
(三)(4)如图为氯碱工业的装置示意图,a端进入的物质为______,工业上还可以利用该装置,以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可制备四甲基氢氧化铵[(CH3)4NOH],则收集到(CH3)4NOH的区域是______(填a、b、c或d),