题目内容
【题目】(一)工业上,在Cu2O/ZnO 作催化剂的条件下发生反应:CO(g)+2H2(g)CH3OH(g) △H
(1)已知:CH3OH(l)=CH3OH(g) △H=+35.2kJmol-1,根据表:
物质 | H2(g) | CO(g) | CH3OH(l) |
燃烧热/kJmol-1 | -285.8 | -283.0 | -726.5 |
反应CO(g)+2H2(g)CH3OH(g) △H=______kJmol-1
(2)向2L恒容密闭容器中通入1mol CO(g)和2mol H2(g),发生反应合成甲醇,反应过程中n(CH3OH)与时间(t)及温度的关系如图1所示。在500℃恒压条件下,请在图1中画出反应体系中n(CH3OH)与时间(t)变化总趋势图。
 ____________
____________
(二)甲醇还可用CO2与H2在催化剂CZZA(普通铜基催化剂)作用下合成,相关反应如下:
反应ⅠCO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=-49.2kJmol-1
反应ⅡCO2(g)+H2(g)CO(g)+H2O(g) △H2=41.2kJmol-1
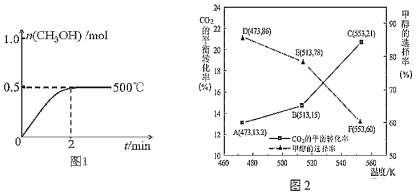
(3)以CZZA/rGO为催化剂,在一定条件下,将1mol CO2与3mol H2通入恒容密闭容器中进行反应I和反应II,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图2所示:
①在553K时,反应体系内CO的物质的量为______ mol
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因:______
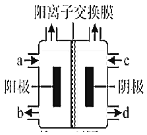
(三)(4)如图为氯碱工业的装置示意图,a端进入的物质为______,工业上还可以利用该装置,以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可制备四甲基氢氧化铵[(CH3)4NOH],则收集到(CH3)4NOH的区域是______(填a、b、c或d),
【答案】-92.9 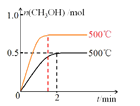 0.084 随温度升高,反应I放热,平衡逆移,反应II吸热,平衡正移且程度较大,所以CO2平衡转化率增加但甲醇的选择率降低 精制饱和食盐水 d
0.084 随温度升高,反应I放热,平衡逆移,反应II吸热,平衡正移且程度较大,所以CO2平衡转化率增加但甲醇的选择率降低 精制饱和食盐水 d
【解析】
(1)H2(g)+![]() O2(g)H2O(l) △H=-285.8kJmol-1①,
O2(g)H2O(l) △H=-285.8kJmol-1①,
CO(g)+![]() O2(g)CO2(g)△H=-283.0kJmol-1②,
O2(g)CO2(g)△H=-283.0kJmol-1②,
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/mol③
O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/mol③
CH3OH(l)=CH3OH (g) △H=+35.2kJmol-1④
将方程式2①+②-③-④得CO(g)+2H2(g)CH3OH(g) △H=(-285.8×2-283.0+726.5-35.2)kJ/mol=-92.9kJ/mol,故答案为:-92.9;
(2)该反应的正反应为气体体积减小的反应,恒容条件下随着反应进行压强逐渐减小,恒压条件下压强不变,与恒容条件相比,相当于增大压强平衡正向移动,且反应速率比恒容条件下大,则反应达到平衡时间缩短,生成的甲醇物质的量增大,所以其图象为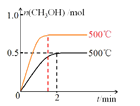 ,故答案为:
,故答案为: ;
;
(3)①在553K时,甲醇的选择率为60%,二氧化碳的转化率为21%,则生成CO消耗的n(CO2)=1mol×21%×(1-60%)=0.084mol,根据C原子守恒计算生成的n(CO)=0.084mol,故答案为:0.084;②升高温度,反应I为放热反应,平衡逆向移动,反应II为吸热反应,平衡正向移动且程度较大,所以CO2平衡转化率增加但甲醇的选择率降低,故答案为:随温度升高,反应I放热,平衡逆移,反应II吸热,平衡正移且程度较大,所以CO2平衡转化率增加但甲醇的选择率降低;
(4)氯碱工业中,阳极上氯离子失电子生成氯气、阴极上水得电子生成氢气和氢氧根离子,离子交换膜为阳离子交换膜,钠离子进入右侧,则a为精制饱和食盐水、b为稀NaCl溶液、d为NaOH溶液、c为稀NaOH溶液;工业上还可以利用该装置,以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可制备四甲基氢氧化铵[(CH3)4NOH],阳极上生成氯气、阴极上生成氢气,四甲基铵离子通过阳离子交换膜加入右侧得到(CH3)4NOH,所以d处得到(CH3)4NOH,
故答案为:精制饱和食盐水;d。