题目内容
【题目】氟铝酸钠(Na3AlF6)是工业炼铝中重要的含氟添加剂。实验室以氟石(CaF2)、石英和纯碱为原料模拟工业制备氟铝酸钠的流程如下:
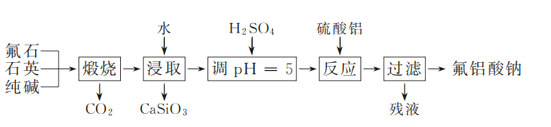
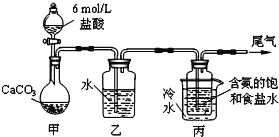
(1) “煅烧”时,固体药品混合后应置于________(填仪器名称)中加热。
(2) 通过控制分液漏斗的活塞可以调节添加液体的速率。调溶液pH接近5时,滴加稀硫酸的分液漏斗的活塞应如下图中的________(填序号)所示。

(3) 在酸性废水中加入Al2(SO4)3、Na2SO4混合溶液,可将废水中F-转换为氟铝酸钠沉淀。
① 该混合溶液中,Al2(SO4)3与Na2SO4的物质的量之比应≥________(填数值)。
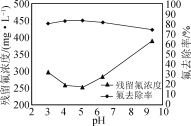
②在不改变其他条件的情况下,加入NaOH调节溶液pH。实验测得溶液中残留氟浓度和氟去除率随溶液pH的变化关系如图所示。pH>5时,溶液中残留氟浓度增大的原因是________。
(4) 若用CaCl2作为沉淀剂除去F-,欲使F-浓度不超过0.95 mg·L-1,c(Ca2+)至少为________mol·L-1。[Ksp(CaF2)=2.7×10-11]
(5) 工业废铝屑(主要成分为铝,少量氧化铁、氧化铝)可用于制取硫酸铝晶体[Al2(SO4)3·18H2O]。
①请补充完整由废铝屑为原料制备硫酸铝晶体的实验方案:取一定量废铝屑,放入烧杯中,____________________________________________________________,得硫酸铝晶体。[已知:pH=5时,Al(OH)3沉淀完全;pH=8.5时,Al(OH)3沉淀开始溶解。须使用的试剂:3 mol·L-1 H2SO4溶液、2 mol·L-1 NaOH溶液、冰水]
②实验操作过程中,应保持强制通风,原因是________。
【答案】铁坩埚 ② ![]() OH-与Al3+结合能力强于F-与Al3+结合能力 0.0108 加入2 mol·L-1 NaOH溶液反应至不再有气泡生成,过滤;向滤液中加入3 mol·L-1 H2SO4,调pH至5~8.5,过滤,洗涤滤渣2~3次;将滤渣转移至烧杯中,加入3 mol·L-1 H2SO4至恰好完全溶解;将溶液蒸发浓缩,冷却结晶,过滤,用少量冰水洗涤,干燥 防止H2与O2混合爆炸
OH-与Al3+结合能力强于F-与Al3+结合能力 0.0108 加入2 mol·L-1 NaOH溶液反应至不再有气泡生成,过滤;向滤液中加入3 mol·L-1 H2SO4,调pH至5~8.5,过滤,洗涤滤渣2~3次;将滤渣转移至烧杯中,加入3 mol·L-1 H2SO4至恰好完全溶解;将溶液蒸发浓缩,冷却结晶,过滤,用少量冰水洗涤,干燥 防止H2与O2混合爆炸
【解析】
(1) 纯碱高温条件下能与二氧化硅反应,据此分析;
(2) 通过控制分液漏斗的活塞可以调节添加液体的速率,注意开关必须慢慢打开;
(3)①根据Al2(SO4)3、Na2SO4反应生成Na3AlF6,考虑Al2(SO4)3水解;
②OH-与Al3+结合能力强于F-与Al3+结合能力,则氟去除率随溶液pH的增大而降低;
(4)根据Ksp(CaF2)= c(Ca2+)×c2(F-)计算;
(5)①已知:pH=5时,Al(OH)3沉淀完全;pH=8.5时,Al(OH)3沉淀开始溶解,据此分析;
②注意应保持强制通风,防止H2与O2混合爆炸。
(1) 纯碱高温条件下能与二氧化硅反应,故 “煅烧”时,固体药品混合后应置于铁坩埚中加热;
(2) 通过控制分液漏斗的活塞可以调节添加液体的速率。注意开关必须慢慢打开调溶液pH接近5时,滴加稀硫酸的分液漏斗的活塞应如下图中的②所示;
(3)①根据氟铝酸钠(Na3AlF6)的分子式可知,完全由Al2(SO4)3、Na2SO4反应生成Na3AlF6时,Al2(SO4)3、Na2SO4的物质的量之比为1:3,但考虑到Al2(SO4)3的水解,故应略大,则Al2(SO4)3与Na2SO4的物质的量之比应≥![]() ;
;
②在不改变其他条件的情况下,加入NaOH调节溶液pH,当pH>5时,OH-与Al3+结合能力强于F-与Al3+结合能力,则氟去除率随溶液pH的增大而降低;
(4) 若用CaCl2作为沉淀剂除去F-,欲使F-浓度不超过0.95 mg·L-1,则浓度为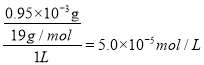 ,根据Ksp(CaF2)= c(Ca2+)×c2(F-)= c(Ca2+)×(5.0×10-5)2=2.7×10-11,则c(Ca2+)至少为0.0108mol·L-1;
,根据Ksp(CaF2)= c(Ca2+)×c2(F-)= c(Ca2+)×(5.0×10-5)2=2.7×10-11,则c(Ca2+)至少为0.0108mol·L-1;
(5)①已知:pH=5时,Al(OH)3沉淀完全;pH=8.5时,Al(OH)3沉淀开始溶解,则由废铝屑为原料制备硫酸铝晶体的实验方案:取一定量废铝屑,放入烧杯中,加入2 mol·L-1 NaOH溶液反应至不再有气泡生成,过滤;向滤液中加入3 mol·L-1 H2SO4,调pH至5~8.5,过滤,洗涤滤渣2~3次;将滤渣转移至烧杯中,加入3 mol·L-1 H2SO4至恰好完全溶解;将溶液蒸发浓缩,冷却结晶,过滤,用少量冰水洗涤,干燥,得硫酸铝晶体;
②实验操作过程中,应保持强制通风,防止H2与O2混合爆炸。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案