题目内容
9.
(1)基态 Cu+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10 .
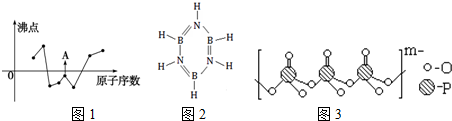
(2)图1曲线表示第二、三周期部分元素的原子序数(按连续递增顺序排列)和其常见单质沸点的关系.其中A点表示的单质是F2(填化学式).
(3)化合物A (H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3,其结构式如图2,通过3CH4+2 (HB=NH)3+6H2O→3CO2+6H3BNH3制得.
①与上述化学方程式有关的叙述不正确的是A.(填标号)
A.反应前后碳原子的轨道杂化类型不变
B.CH4、H2O、CO2分子空间构型分别是:正四面体型、V形、直线形
C.第一电离能:N>O>C>B
D.化合物A中存在配位键
②1个 (HB=NH)3分子中有12个σ键.
(4)海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如下图3.
①磷原子的杂化类型为sp3.
②这种多聚磷酸钠的化学式为Nan+2PnO3n+1.
(5)已知HF与F-通过氢键结合成HF2-.判断HF2-和HF2-微粒间能否形成氢键,并说明理由.在HF2-中,已经存在分子内氢键(F-H…F-),所以没有可用于形成分子间氢键的氢原子.
分析 (1)Cu原子核外有29个电子,失去一个电子生成亚铜离子,根据构造原理书写其核外电子排布式;
(2)图中曲线表示8种元素的原子序数(按递增顺序连续排列)和单质沸点的关系,A以及前面的2种单质的沸点都低于0℃,则连续3种均为气体单质,根据周期表分析;
(3)①由方程式可知:碳元素由CH4变为CO2,碳原子杂化类型由sp3转化为sp;
②根据无机苯中氮原子和硼原子都采取sp2杂化分析;
(4)①根据价层电子对互斥理论确定其杂化方式,
②由给出的多聚磷酸根结构式知,含有n个多聚磷酸根离子,相当于是n个磷酸根离子中去掉了(n-1)氧原子,从而确定分子式;
(5)氢键结合的通式,可用X-H…Y表示.式中X和Y代表F,O,N等电负性大而原子半径较小的非金属原子.X和Y可以是两种相同的元素,也可以是两种不同的元素.
解答 解:(1)Cu原子失去1个电子生成Cu+,Cu+核外有28个电子,失去的电子数是其最外层电子数,根据构造原理知Cu+基态核外电子排布式1s22s22p63s23p63d10或[Ar]3d10 ,故答案为:1s22s22p63s23p63d10或[Ar]3d10 ;结构上Cu2+为3d9,而Cu+为3d10全充满更稳定;
(2)图中曲线表示8种元素的原子序数(按递增顺序连续排列)和单质沸点的关系,A以及前面的2种单质的沸点都低于0℃,则连续3种均为气体单质,在周期表中,连续出现气体单质的为第二周期的N、O、F,所以A为第三种气体单质,则为F2;
故答案为:F2;
(3)①3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3,
A.由CH4变为CO2,碳原子杂化类型由sp3转化为sp,反应前后碳原子的轨道杂化类型已经改变,故A错误;
B.CH4分子中价层电子对=σ 键电子对+中心原子上的孤电子对=4+$\frac{1}{2}$×(4-4×1)=4,且不含孤电子对,所以其空间构型是正四面体,H2O中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,CO2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+$\frac{1}{2}$×(4-2×2)=2,所以二氧化碳是直线型结构,故B正确;
C.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,这几种元素都是第二周期元素,它们的族序数分别是:第IIIA族、第IVA族、第VA族、第VIA族,所以它们的第一电离能大小顺序是I1(N)>I1(O)>I1(C)>I1(B),故C正确;
D.B一般是形成3个键,(H3BNH3)由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得,其中1个键是配位键,故D正确;
故答案为:A;
②1个(HB=NH)3分子中硼原子与氮原子间以σ键结合,而剩余的p轨道形成一个共轭大π键.B-H键有3个,N-H键有3个,B-N有σ键有6个,故一共12个;
故答案为:12;
(4)①磷原子形成了四个σ键,没有孤电子对,价电子对数为4,故呈sp3杂化;
故答案为:sp3;
②由给出的多聚磷酸根结构式知,含有n个多聚磷酸根离子,相当于是n个磷酸根离子中去掉了(n-1)氧原子,所带电荷为-2×(3n+1)+5n=-(n+2),由化合价规则知磷酸钠的组成为Nan+2PnO3n+1;
故答案为:Nan+2PnO3n+1;
(5)在HF2-中,已经存在分子内氢键(F-H…F-),所以没有可用于形成分子间氢键的氢原子,故HF2-和HF2-微粒间不能形成氢键,
故答案为:在HF2-中,已经存在分子内氢键(F-H…F-),所以没有可用于形成分子间氢键的氢原子,故HF2-和HF2-微粒间不能形成氢键.
点评 本题考查物质结构和性质,综合性较强,涉及氢键、原子杂化方式判断、原子核外电子排布、电离能等知识点,侧重考查基本理论,明确氢键形成条件、价层电子对互斥理论、构造原理、元素周期律等知识即可解答,难点是价层电子对互斥理论内涵,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | H2O | B. | NaOH溶液 | C. | Fe | D. | 浓H2SO4 |
| A. | 碱性:KOH>NaOH | B. | 元素的金属性:Mg>Al | ||
| C. | 酸性:HClO4>H2SO4 | D. | 相对分子质量:Ar>K |
| A. | 加成反应 | B. | 分解反应 | C. | 置换反应 | D. | 氧化还原反应 |
| A. | 向该溶液中加入Mg有H2逸出 | |
| B. | 向该溶液中加入少量FeCl2,其离子反应方程式为:2NO3-+6I-+4H2O | |
| C. | 该溶液还可能大量存在MnO4-、ClO- | |
| D. | 向该溶液中逐滴加入Na2CO3溶液至过量,既有气体逸出又有沉淀生成 |
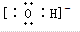 ;粒子E的名称是水合氢离子;粒子F对应的元素在周期表中的位置是第三周期、ⅢA族.
;粒子E的名称是水合氢离子;粒子F对应的元素在周期表中的位置是第三周期、ⅢA族.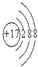

 ,化合物中含有离子键键(填离子或共价)
,化合物中含有离子键键(填离子或共价)