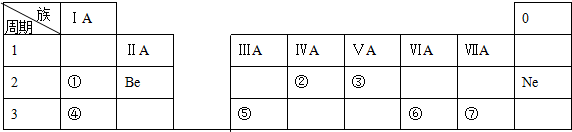
题目内容
1.用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )①常温常压下,46g有机物C2H6O中含有极性键的数目一定为7NA;
②标准状况下,22.4L四氯化碳中所含有的共价键数目为4NA;
③常温下46g NO2和N2O4混合气体中含有原子数为3NA;
④常温常压下,33.6L氯气与56g铁充分反应,转移的电子数为3NA;
⑤足量铁在氯气中反应,l mol铁失去的电子数为2NA;
⑥标准状况下22.4L H2中含中子数为2NA;
⑦1L Imol/L的盐酸溶液中,所含氯化氢分子数为NA.
| A. | ①④ | B. | ②⑤⑥ | C. | ③ | D. | ②④⑦ |
分析 ①依据n=$\frac{m}{M}$计算物质的量,结合有机物C2H6O存在同分异构体分析;
②标准状况下,四氯化碳为液态;
③NO2和N2O4的最简式均为NO2;
④常温常压下气体摩尔体积大于22.4L/mol;
⑤铁在氯气中反应,铁变为+3价;
⑥H2中不含中子;
⑦盐酸溶液无氯化氢分子.
解答 解:①依据n=$\frac{m}{M}$计算物质的量=$\frac{46g}{46g/mol}$=1mol,有机物C2H6O存在同分异构体,若为乙醇含有极性键的数目一定为7NA,若为甲醚含有极性键的数目一定为8NA,故①错误;
②标准状况下,四氯化碳为液态,不能根据气体摩尔体积来计算,故②错误;
③NO2和N2O4的最简式均为NO2,46g NO2和N2O4混合气体中含有NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,故含有3mol原子,即3NA个,故③正确;
④常温常压下气体摩尔体积大于22.4L/mol,故33.6L氯气的物质的量小于1.5mol,故铁过量,则转移的电子的物质的量小于3NA个,故④错误;
⑤铁在氯气中反应,铁变为+3价,故1mol铁失去3mol电子,即3NA个,故⑤错误;
⑥H2中不含中子,故标况下22.4L氢气即1mol氢气中无中子,故⑥错误;
⑦HCl溶于水后完全电离为氢离子和氯离子,故盐酸溶液无氯化氢分子,故⑦错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
12.下列措施对增大反应速率明显有效的是( )
| A. | Na与水反应时增大水的用量 | |
| B. | Fe与稀硫酸反应制取氢气时,改用浓硫酸 | |
| C. | 将锌与稀硫酸反应时,向溶液中加入少量CuSO4 晶体 | |
| D. | 用碳还原Fe2O3冶炼铁时,增大碳的用量 |
16.从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作.下列图示对应的装置合理,操作规范的是( )
| A. |  灼烧 | B. |  过滤 | ||
| C. |  分液 | D. |  蒸馏 |
6.下列关于电离常数的说法正确的是( )
| A. | 电离常数随着弱电解质浓度的增大而增大 | |
| B. | CH3COOH的电离常数表达式为Ka=$\frac{c(C{H}_{3}COOH)}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$ | |
| C. | 电离常数只受温度影响,与浓度无关 | |
| D. | CH3COOH溶液中加入少量CH3COONa固体,电离常数减小 |
13.下列关于卤素及其化合物的叙述错误的是( )
| A. | 非金属性:F>Cl>Br>I | B. | 单质氧化性:F2>Cl2>Br2>I2 | ||
| C. | 氢化物稳定性:HF>HCl>HBr>HI | D. | 沸点:F2>Cl2>Br2>I2 |
10.下列各项中表达正确的是( )
| A. | F-的结构示意图: | B. | CO2的分子模型示意图: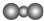 | ||
| C. | N2的结构式::N≡N: | D. | CSO的电子式: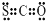 |
11.下列事实不能用勒沙特列原理解释的是( )
| A. | 氨水应密闭保存,放置低温处 | |
| B. | 在FeSO4溶液中,加入Fe粉以防止变质 | |
| C. | 生产硝酸的过程中使用过量空气以提高氨气的利用率 | |
| D. | 实验室常用排饱和食盐水的方法收集Cl2 |