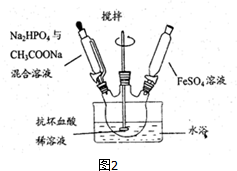
题目内容
10.下列离子方程式书写正确的是( )| A. | 强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2 FeO42-+3Cl-+H2O+4H+ | |
| B. | 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-=NH3•H2O | |
| C. | NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2+十OH-═BaSO4↓+H2O | |
| D. | 把少量碳酸氢钠溶液加入到氢氧化钡溶液中:HCO3-+Ba2++OH-=BaCO3↓+H2O |
分析 A.强碱性溶液中,反应产物中不能存在氢氧根离子;
B.氢氧化钠溶液足量,铵根离子和碳酸氢根离子都与氢氧根离子反应,离子方程式NH4++OH-=NH3•H2O中漏掉了碳酸氢根离子与氢氧根离子的反应;
C.溶液为中性,硫酸氢钠与氢氧化钡的物质的量之比为2:1;
D.氢氧化钡足量,离子方程式按照碳酸氢钠的化学式书写.
解答 解:A.强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4,正确的离子反应方程式为:2Fe(OH)3+3ClO-+4OH-→2FeO42-+3Cl-+5H2O,故A错误;
B.碳酸氢铵与足量NaOH溶液混合反应生成碳酸钠和一水合氨,正确的离子方程式为:2OH-+NH4++HCO3-=CO32-+NH3•H2O+H2O,故B错误;
C.NaHSO4溶液中滴入Ba(OH)2溶液至中性,氢离子与氢氧根离子的物质的量相等,正确的离子方程式为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故C错误;
D.少量碳酸氢钠溶液加入到氢氧化钡溶液中,反应生成碳酸钡沉淀和水,反应的离子方程式为::HCO3-+Ba2++OH-=BaCO3↓+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
12.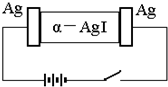 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )| A. | 若α-AgI是Ag+导电则通电一段时间后晶体密度不均匀 | |
| B. | 若α-AgI是Ag+导电则通电一段时间后晶体密度可能均匀 | |
| C. | 若α-AgI是I-导电则通电一段时间后晶体密度不均匀 | |
| D. | 若α-AgI是I-导电则通电一段时间后晶体密度仍均匀 |
15.下列元素中,最高正化合价最大的是( )
| A. | C | B. | F | C. | S | D. | Ne |
2.在如图所示的装置中,a的金属活动性排在氢之前,b为碳棒,关于此装置的各种叙述正确的是( )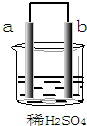

| A. | b极上发生了还原反应 | |
| B. | a是正极,b是负极 | |
| C. | a极上放出气体,溶液的pH增大 | |
| D. | 导线中有电子流动,电子从b极流到a极 |
19.下列排列顺序不正确的是( )
| A. | 原子半径:Na>S>O | B. | 酸性:H3PO4>H2SO4>HClO4 | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 元素金属性:Na>Mg>Al |
 (1)反应A+3B?2C+2D在四种不同情况下的反应速率分别如下:
(1)反应A+3B?2C+2D在四种不同情况下的反应速率分别如下: