题目内容
【题目】关于图中装置说法正确的是

A. 装置中电流移动的途径:正极→Fe→M溶液→石墨→正极
B. 若M为滴加酚酞的NaCl溶液,通电一段时间后,铁电极附近溶液显红色
C. 若M为CuSO4溶液,可以实现石墨上镀铜
D. 若将电源反接,M为NaCl溶液,可以用于制备Fe(OH)2并可以使其较长时间保持白色
【答案】B
【解析】
该装置是电解池,且惰性电极作正极,阳极上失电子发生氧化反应,阴极上得电子发生还原反应;电解池工作时,电子从负极到阴极,从阳极到正极,据此分析解答。
A.该装置是电解池,电子只能沿着导线移动,不能进入溶液中,A错误;
B. 铁电极为阴极,溶液中的氢离子在此极得电子变为氢气,溶液中的氢氧根离子浓度增大,碱性增强,酚酞遇碱变红,B正确;
C. 待镀石墨做阴极,镀层金属铜做阳极,才能实现石墨上镀铜,C错误;
D. 若将电源反接,铁做阳极,铁失电子生成亚铁离子;石墨做阴极,溶液中的氢离子在此极得电子变为氢气,溶液中的氢氧根离子浓度增大,亚铁离子和氢氧根离子反应生成氢氧化亚铁沉淀,但是溶液中的氧气能够把氢氧化亚铁氧化为氢氧化铁红褐色沉淀,氢氧化亚铁不能较长时间保持白色,D错误;
综上所述,本题选B。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】1 L某混合溶液,可能含有的离子如下表:
阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
(1)向该溶液中逐滴加入cmol/L NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中一定含有的离子是______________。
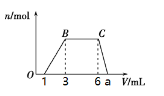
(2)根据图像数据计算a=_______________mL
(3)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2 L |
n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
n(I-) | x mol(x≠0) | 0 | 0 |
①当通入Cl2的体积为5.6L时,溶液中发生反应的离子方程式为______________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________________。
③x=_________________mol
【题目】根据下表中部分短周期元素的原子半径及主要化合价信息:
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.152 | 0.143 | 0.160 | 0.102 | 0.074 |
主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
请判断以下叙述正确的是( )
A. 氢化物的沸点为H2T<H2R
B. L+与T2-的核外电子数相等
C. 单质L在空气中燃烧生成的氧化物中,氧元素化合价为-1价
D. M与T形成的二元化合物具有两性
【题目】中学化学中下列各物质间不能实现 (“→”表示一步完成)转化的是
(“→”表示一步完成)转化的是
选项 | A | B | C | D |
a | CH3CH2OH | CH2=CH2 | Cl2 | C |
b | CH3CHO | CH3CH2Br | HClO | CO |
c | CH3COOH | CH3CH2OH | HCl | CO2 |
A. AB. BC. CD. D


