题目内容
(1)元素的第一电离能Al Si(填“>”或“<”)。
(2)基态Mn2+的核外电子排布式为 。
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是 。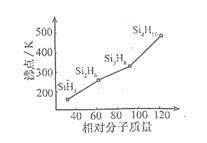
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示: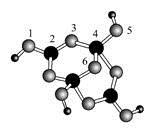
①在Xm-中,硼原子轨道的杂化类型有 ;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有 (填序号)。
A、离子键 B、共价键 C、金属键 D、范德华力 E、氢键
(1)<
(2)1s22s22p63s23p63d5 ([Ar]3d5)
(3)硅烷的相对分子质量越大,分子间作用力越强
(4)①sp2、sp3;4、5(或5,4) ;2 ②ADE
解析

练习册系列答案
相关题目
(13分)(1)钠镁铝三种元素中第一电离能最大的是 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
| A.NH4Cl晶体 | B.Na3AlF6晶体 | C.Na2CO3?10H2O晶体 |
| D.CuSO4溶液 E. CH3COOH溶液 |
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 159 | 418 | 945 |
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| | 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4 °C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。
(14分)下表列出了A—R九种元素在周期表中的位置,用元素符号或化学式填空。
 主族 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | E | | F | | |
| 3 | A | C | D | | | | G | R |
| 4 | B | | | | | | H | |
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是 。
(3)A、B、C三种元素按原子半径由大到小的顺序排列的为 。
(4)F的氢化物的电子式 ;G、H 氢化物的稳定性递减的顺序是 。
(5)H元素跟A元素形成的化合物的化学式是 ;A2F2的电子式是 ;。
(6)B和F两种元素形成的2:1型化合物属于 (填“离子化合物”或“共价化合物”),请用电子式表示其形成过程 。
(7)国际无机化学命名委员会在1989年作出决定, 把元素周期表的主、副族及其族号取消, 由左至右改为1~18列。按这个规定,第15列元素应为 族元素,其简单氢化物的化学式为 (用字母“M”表示该族元素)
下表为元素周期表的一部分,请回答有关问题:
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | ① | ② | ③ | |
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
(1)表中最活泼的金属是 ,非金属性最强的元素是 (填写元素符号)。
(2)表中能形成两性氢氧化物的元素名称是 ,写出该元素的氢氧化物与④的最高价氧化物对应水化物反应的离子方程式: 。
(3)元素⑨和元素⑩的最高价氧化物的水化物中酸性较强是 (用化学式表示)。
(4)元素⑩与元素⑤形成的化合物属于 (填 “共价”或“离子”)化合物。
(5)请画出元素②的原子结构示意图为 ,元素①的单质在常温下化学性质稳定,通常可以做保护气,请用电子式表示其分子 。
 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
 , 试回答:
, 试回答: