题目内容
5. 某元素的原子最外层电子数是次外层电子数的两倍,该元素是碳;它在元素周期表中的位置是第二周期第ⅣA族;该元素和氢元素组成的某种有机物是“西气东输”中“气”的主要成分,这种有机物的电子式为
某元素的原子最外层电子数是次外层电子数的两倍,该元素是碳;它在元素周期表中的位置是第二周期第ⅣA族;该元素和氢元素组成的某种有机物是“西气东输”中“气”的主要成分,这种有机物的电子式为 ;结构式
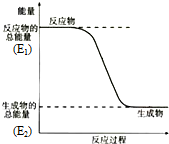
;结构式 ;空间构型:正四面体.这种化合物中碳元素的质量分数为75%.该物质在氧气中充分燃烧的反应方程式:CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填写“>”或者“<”),该反应放热(填写“放出”或者“吸收”)能量.该物质与Cl2反应方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl(只写出第一步反应),该反应类型为取代反应.
;空间构型:正四面体.这种化合物中碳元素的质量分数为75%.该物质在氧气中充分燃烧的反应方程式:CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填写“>”或者“<”),该反应放热(填写“放出”或者“吸收”)能量.该物质与Cl2反应方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl(只写出第一步反应),该反应类型为取代反应.
分析 某元素的原子最外层电子数是次外层电子数的两倍,则有2个电子层、最外层电子数为4,可知质子数为6,则此元素为碳;
CH4 分子中,碳原子与4个氢原子分别共用一对电子,形成4个C-H键;
甲烷是碳原子和氢原子间通过共价单键形成的空间正四面体结构;
甲烷燃烧生成二氧化碳和水;
反应物的总能量高于生成物的总能量,则为放热反应;
氯气光照条件下与甲烷生成一氯甲烷(第一步反应),此反应为取代反应.
解答 解:某元素的原子最外层电子数是次外层电子数的两倍,由于最外层电子数不能超过8,所以该元素核外电子只能有2个电子层,最外层电子数为4,所以质子数是6,该元素是碳元素,C处于元素周期表中第二周期第IVA族,碳与氢组合最简单的化合物是甲烷,化学式是CH4,碳原子最外层的4个电子分别与氢原子形成共用电子对,电子式为 ,结构式为:
,结构式为: ,是正四面体结构,CH4中碳元素质量分数是:$\frac{12}{12+1×4}$×100%=75%,甲烷完全燃烧生成二氧化碳和水,化学反应方程式为:CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O,从图中得出反应物的总能量(E1)高于生成物的总能量(E2),故此反应为放热反应,甲烷与氯气反应生成一氯甲烷,此反应为取代反应,化学反应方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,
,是正四面体结构,CH4中碳元素质量分数是:$\frac{12}{12+1×4}$×100%=75%,甲烷完全燃烧生成二氧化碳和水,化学反应方程式为:CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O,从图中得出反应物的总能量(E1)高于生成物的总能量(E2),故此反应为放热反应,甲烷与氯气反应生成一氯甲烷,此反应为取代反应,化学反应方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,
故答案为:碳;第二周期第ⅣA族; ;
; ;正四面体;75%;CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O;>;放热;CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;取代.
;正四面体;75%;CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O;>;放热;CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;取代.
点评 本题主要考查的是元素的推断以及甲烷的分子式、电子式、结构式以及甲烷的化学性质和常见有机化学反应类型,难度不大.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
15.合金的用途广泛.下列物质不属于合金的是( )
| A. | 水银 | B. | 青铜 | C. | 硬铝 | D. | 不锈钢 |
20.下列电子式中,书写正确的是( )
| A. | 过氧化钠 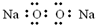 | B. | 氟化氢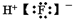 | C. | 氮气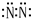 | D. | 氯化镁 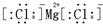 |
10.随着碱金属元素原子序数的增大,下列递变规律正确的是( )
| A. | 原子半径逐渐增大 | B. | 碱性逐渐减弱 | ||
| C. | 单质熔、沸点逐渐升高 | D. | 单质的氧化性逐渐增强 |
17.可逆反应2NO2(红棕色)?2NO(无色)+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
①单位时问内生成n mo1O2的同时生成2nmolNO2
②单位时间内生成n molO2的同时生成2nmolNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
①单位时问内生成n mo1O2的同时生成2nmolNO2
②单位时间内生成n molO2的同时生成2nmolNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②③④⑤ |
14.下列有关水溶液中离子平衡关系的说法中,正确的是( )
| A. | 在0.1 mol•L-1FeCl3溶液中,Na+、NH4+、HCO3-、ClO-一定大量共存 | |
| B. | 常温下,某溶液中由水电离出的c(H+)=1×10-amol•L-1,则该溶液一定pH=a | |
| C. | 相同物质的量浓度下列溶液:①NH4Al(SO4)2;②NH4Cl;③CH3COONH4;④NH3•H2O.其中c(NH4+)由大到小的顺序是①>②>③>④ | |
| D. | AgCl悬浊液中存在如下平衡:AgCl(s)?Ag+(aq)+Cl-(aq).向其中加入少量NaCl晶体,平衡逆向移动,故AgCl溶解度减少,溶度积Ksp也减少 |
8.2010年诺贝尔化学奖化学授予理查德•赫克等三位科学家,以表彰他们在“钯催化交叉偶联”方面的研究.下面关于催化剂的说法正确的是( )
| A. | 催化剂能够改变反应的反应热 | |
| B. | 催化剂能够改变反应物的活化分子百分数 | |
| C. | 催化剂能改变反应物的转化率 | |
| D. | 催化剂通过升高反应的活化能来加快反应速率 |
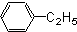 芳香烃,(7)
芳香烃,(7)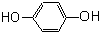 酚,(8)
酚,(8)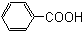 芳香酸.
芳香酸.
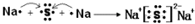 ,其所含化学键类型为离子键.
,其所含化学键类型为离子键.