题目内容
17.可逆反应2NO2(红棕色)?2NO(无色)+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )①单位时问内生成n mo1O2的同时生成2nmolNO2
②单位时间内生成n molO2的同时生成2nmolNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②③④⑤ |
分析 ①单位时间内生成n mol O2,同时生成2n molNO2,因此v正=v逆;
②在任何时候,反应速率之比等于化学计量数之比,不能说明达到平衡状态;
③混合气体的颜色不再改变,说明NO2气体的浓度不变;
④在任何时候,混合气体的质量不变,容器的体积不变,所以混合气体的密度不变,不能说明达到平衡状态;
⑤反应前后气体的物质的量不同,混合气体质量不变.
解答 解:①单位时间内生成n mol O2,同时生成2n molNO2,说明反应v正=v逆,达到平衡状态,故①正确;
②无论反应是否达到平衡状态,反应速率之比等于化学计量数之比,不能说明达到平衡状态,故②错误;
③混合气体的颜色不再改变,说明NO2气体的浓度不变,达到平衡状态,故③正确;
④无论反应是否达到平衡状态,混合气体的质量不变,容器的体积不变,所以混合气体的密度不变,不能说明达到平衡状态,故④错误;
⑤混合气体的平均相对分子质量=$\frac{混合气体的总质量}{混合气体的总物质的量}$,混合气体质量不变,反应前后气体的物质的量不同,所以平均相对分子质量不变,说明各组分浓度不变,反应达到平衡状态,故⑤正确;
故选B.
点评 本题考查化学平衡状态的判断,难度不大,做题时注意分析化学方程式的前后计量数大小的关系.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
7.下列说法正确的是( )
| A. | 明矾溶于水产生Al(OH)3 胶体,离子方程式可表示为:Al3++3H2O═Al(OH)3↓+3H+ | |
| B. | 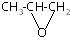 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物 ,该反应符合绿色化学的原则 ,该反应符合绿色化学的原则 | |
| C. | 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 | |
| D. | 聚氯乙烯塑料制品可用于食品的包装 |
12.下列化学反应既是氧化还原反应,又是反应物总能量低于生成物总能量的是( )
| A. | 甲烷在氧气中的燃烧反应 | B. | 铝与稀盐酸的反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl的反应 | D. | 灼热的碳与二氧化碳的反应 |
2.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应( )
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丙烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 丙烷与氯气在光照的条件下发生取代反应生成一氯代物的反应 | |
| D. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 |
9.用图中装置进行实验,实验一段时间后,现象与预测不一致的是( )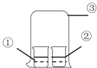

| ①中物质 | ②中物质 | 实验预测 | |
| A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
| B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
| C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
| D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
| A. | A | B. | B | C. | C | D. | D |
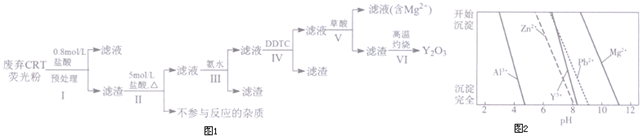
6.稀土是一种不可再生的战略性资源,被广泛应用于电子信息、国防军工等多个领域.一种从废弃阴极射线管(CRT)荧光粉中提取稀土元素钇(Y)的工艺流程如图1:
已知:①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如表一所示;
②不同离子沉淀的pH如图2所示.
(1)步骤I中进行原料预处理的目的为除去ZnO和Al2O3;富集稀土元素;降低后续耗酸量.
(2)步骤Ⅱ中有黄绿色气体产生,该反应的化学方程式为PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
(3)步骤Ⅲ中发生的主要反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)步骤Ⅳ中除杂试剂DDTC除去的杂质离子有Zn2+、Pb2+,其不能通过直接加碱的方法除去,原因为Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离.
(5)步骤V中Y3+沉淀完全时,需保证滴加草酸后的溶液中c(C2O42-)不低于2.0×10-6mol/L.
(已知:当离子浓度小于10-5mol/L时,沉淀就达完全;K甲[Y2(C2O4)3]=8.0×10-28
(6)步骤Ⅵ中草酸钇隔绝空气加热可以得到Y2O3,该反应的化学方程式为Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑.
已知:①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如表一所示;
②不同离子沉淀的pH如图2所示.
| 成分 含量/% 阶段 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 预处理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 预处理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
(2)步骤Ⅱ中有黄绿色气体产生,该反应的化学方程式为PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
(3)步骤Ⅲ中发生的主要反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)步骤Ⅳ中除杂试剂DDTC除去的杂质离子有Zn2+、Pb2+,其不能通过直接加碱的方法除去,原因为Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离.
(5)步骤V中Y3+沉淀完全时,需保证滴加草酸后的溶液中c(C2O42-)不低于2.0×10-6mol/L.
(已知:当离子浓度小于10-5mol/L时,沉淀就达完全;K甲[Y2(C2O4)3]=8.0×10-28
(6)步骤Ⅵ中草酸钇隔绝空气加热可以得到Y2O3,该反应的化学方程式为Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑.

20.温度一定时,用水稀释0.1mol•L-1氨水时,随着水量的增加而减小的是( )
| A. | $\frac{c(O{H}^{-})•c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$ | ||
| C. | c(H+)和c(OH-)的乘积 | D. | OH-的物质的量 |
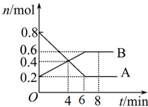 某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示.
某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示.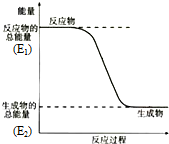 某元素的原子最外层电子数是次外层电子数的两倍,该元素是碳;它在元素周期表中的位置是第二周期第ⅣA族;该元素和氢元素组成的某种有机物是“西气东输”中“气”的主要成分,这种有机物的电子式为
某元素的原子最外层电子数是次外层电子数的两倍,该元素是碳;它在元素周期表中的位置是第二周期第ⅣA族;该元素和氢元素组成的某种有机物是“西气东输”中“气”的主要成分,这种有机物的电子式为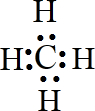 ;结构式
;结构式 ;空间构型:正四面体.这种化合物中碳元素的质量分数为75%.该物质在氧气中充分燃烧的反应方程式:CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填写“>”或者“<”),该反应放热(填写“放出”或者“吸收”)能量.该物质与Cl2反应方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl(只写出第一步反应),该反应类型为取代反应.
;空间构型:正四面体.这种化合物中碳元素的质量分数为75%.该物质在氧气中充分燃烧的反应方程式:CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填写“>”或者“<”),该反应放热(填写“放出”或者“吸收”)能量.该物质与Cl2反应方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl(只写出第一步反应),该反应类型为取代反应.