题目内容
10.随着碱金属元素原子序数的增大,下列递变规律正确的是( )| A. | 原子半径逐渐增大 | B. | 碱性逐渐减弱 | ||
| C. | 单质熔、沸点逐渐升高 | D. | 单质的氧化性逐渐增强 |
分析 A.同主族元素从上到下原子电子层半径依次增多;
B.金属性越强,最高价氧化物对应水化物碱性越强;
C.金属原子半径越大,金属键越弱,熔沸点越低;
D.元素金属性越强,金属阳离子氧化性越弱.
解答 解:A.碱金属同主族,从上到下,电子层增大,原子半径依次增大,故A正确;
B.从上到下,碱金属金属性依次增强,最高价氧化物对应水化物的碱性依次增强,故B错误;
C.碱金属,从上到下,原子半径依次增大,金属键依次减弱,熔沸点依次降低,故C错误;
D.碱金属从上到下元素金属性依次增强,金属阳离子氧化性依次越弱,故D错误;
故选:A.
点评 本题考查了碱金属性质,明确同主族元素性质递变规律是解题关键,题目难度不大,注意金属晶体熔沸点规律.

练习册系列答案
相关题目
1.下列溶液肯定呈酸性的是( )
| A. | 含有 H+离子的溶液 | B. | 酚酞显无色的溶液 | ||
| C. | c(OH-)<c(H+)的溶液 | D. | pH 小于 7 的溶液 |
18.某元素X的气态氢化物的分子式为H2X,则X的最高价含氧酸的分子式为( )
| A. | H2XO3 | B. | H2XO4 | C. | HXO3 | D. | HXO4 |
15.在10L容器中进行如下反应:N2+3H2?2NH3,3秒钟后,NH3的物质的量增加0.12mol,用H2浓度的变化表示3秒钟内的平均反应速率为( )
| A. | 0.009 mol/(L•s) | B. | 0.006mol/(L•s) | C. | 0.045mol/(L•s) | D. | 0.003mol/(L•s) |
2.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应( )
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丙烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 丙烷与氯气在光照的条件下发生取代反应生成一氯代物的反应 | |
| D. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 |
19.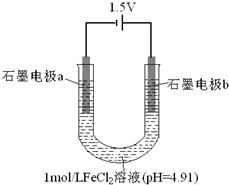 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
Ⅰ电极a表面始终未出现气泡,但产生了银灰色有金属光泽的固体.该电极的电极反应式为:Fe2++2e-=Fe.
Ⅱ电极b开始一段时间内,表面无气泡产生,周围液体出现红褐色,逐渐浑浊.吸取该电极周围少许液体于两支试管中,一支试管中滴入淀粉-KI溶液,液体颜色不变;另一支试管中先加盐酸酸化,再滴入KSCN溶液,溶液变为红色.
结论:电解过程中产生了Fe3+,同时水解产生了红褐色物质.
(1)加盐酸酸化时发生的反应是Fe(OH)3+3H+=Fe3++3H2O(用离子方程式表示).
(2)对电解过程中Fe3+产生的原因进行猜想:
猜想①:Cl-在阳极放电,生成的Cl2将Fe2+氧化成Fe3+;
猜想②:Fe2+在阳极直接放电生成Fe3+;
猜想③:….
(3)设计实验验证猜想①
供选择的试剂:1mol/L FeSO4溶液、1mol/L盐酸、2mol/L盐酸、1mol/L NaCl溶液、2mol/L NaCl溶液、淀粉-KI溶液、KSCN溶液、蒸馏水
 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)Ⅰ电极a表面始终未出现气泡,但产生了银灰色有金属光泽的固体.该电极的电极反应式为:Fe2++2e-=Fe.
Ⅱ电极b开始一段时间内,表面无气泡产生,周围液体出现红褐色,逐渐浑浊.吸取该电极周围少许液体于两支试管中,一支试管中滴入淀粉-KI溶液,液体颜色不变;另一支试管中先加盐酸酸化,再滴入KSCN溶液,溶液变为红色.
结论:电解过程中产生了Fe3+,同时水解产生了红褐色物质.
(1)加盐酸酸化时发生的反应是Fe(OH)3+3H+=Fe3++3H2O(用离子方程式表示).
(2)对电解过程中Fe3+产生的原因进行猜想:
猜想①:Cl-在阳极放电,生成的Cl2将Fe2+氧化成Fe3+;
猜想②:Fe2+在阳极直接放电生成Fe3+;
猜想③:….
(3)设计实验验证猜想①
供选择的试剂:1mol/L FeSO4溶液、1mol/L盐酸、2mol/L盐酸、1mol/L NaCl溶液、2mol/L NaCl溶液、淀粉-KI溶液、KSCN溶液、蒸馏水
| 操作 | 现象和结论 |
| ①取一定量2mol/LNaCl溶液,调节溶液pH为4.91;再以相同装置进行电解. ②电解相同时间后,若电极b表面无气泡,取少量阳极附近的溶液, 滴入淀粉KI溶液. | 若溶液不变蓝,证明猜想①不成立 若溶液变蓝,证明猜想①可能成立. |
13.设反应①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)?FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
(1)从上表可推断,反应①是吸热(填“放”或“吸”)热反应;
(2)现有反应③H2(g)+CO2(g)?CO(g)+H2O(g)△H=Q3平衡常数为K3
a.根据反应①与②推导出K1、K2、K3的关系式K3=$\frac{{K}_{1}}{{K}_{2}}$;可推断反应③是吸(填“放”或“吸”)热反应.要使反应③在一定条件下建立的平衡右移,可采取的措施有BD.
A.缩小容器体积 B.升高温度 C.使用合适的催化剂 D.设法减少CO的量 E.降低温度
b.根据反应①与②推导出Q1、Q2、Q3的关系式Q3=Q1-Q2.
| 温度( T ) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(2)现有反应③H2(g)+CO2(g)?CO(g)+H2O(g)△H=Q3平衡常数为K3
a.根据反应①与②推导出K1、K2、K3的关系式K3=$\frac{{K}_{1}}{{K}_{2}}$;可推断反应③是吸(填“放”或“吸”)热反应.要使反应③在一定条件下建立的平衡右移,可采取的措施有BD.
A.缩小容器体积 B.升高温度 C.使用合适的催化剂 D.设法减少CO的量 E.降低温度
b.根据反应①与②推导出Q1、Q2、Q3的关系式Q3=Q1-Q2.
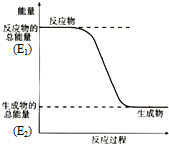 某元素的原子最外层电子数是次外层电子数的两倍,该元素是碳;它在元素周期表中的位置是第二周期第ⅣA族;该元素和氢元素组成的某种有机物是“西气东输”中“气”的主要成分,这种有机物的电子式为
某元素的原子最外层电子数是次外层电子数的两倍,该元素是碳;它在元素周期表中的位置是第二周期第ⅣA族;该元素和氢元素组成的某种有机物是“西气东输”中“气”的主要成分,这种有机物的电子式为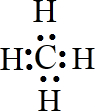 ;结构式
;结构式 ;空间构型:正四面体.这种化合物中碳元素的质量分数为75%.该物质在氧气中充分燃烧的反应方程式:CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填写“>”或者“<”),该反应放热(填写“放出”或者“吸收”)能量.该物质与Cl2反应方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl(只写出第一步反应),该反应类型为取代反应.
;空间构型:正四面体.这种化合物中碳元素的质量分数为75%.该物质在氧气中充分燃烧的反应方程式:CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填写“>”或者“<”),该反应放热(填写“放出”或者“吸收”)能量.该物质与Cl2反应方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl(只写出第一步反应),该反应类型为取代反应.