题目内容
【题目】实验: ①0.1molL﹣1AgNO3溶液和0.1molL﹣1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加几滴0.1molL﹣1KI溶液,出现浑浊;
③向沉淀c中滴加几滴0.1molL﹣1KI溶液,沉淀变为黄色.
下列分析不正确的是
A. 浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl﹣(aq)
Ag+(aq)+Cl﹣(aq)
B. ③中颜色变化说明AgCl转化为AgI
C. 实验可以证明AgI比AgCl更难溶
D. 滤液b中不含有Ag+
【答案】D
【解析】试题分析:A.浊液a中含有AgCl,存在沉淀的溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),A正确;B.向AgCl中滴加0.1mol/LKI溶液,白色AgCl沉淀变为黄色AgI沉淀,B正确;C.向AgCl中滴加0.1mol/LKI溶液,白色AgCl沉淀变为黄色AgI沉淀,实验证明AgI比AgCl更难溶,C正确;D.滤液为AgCl的饱和溶液,也存在沉淀的溶解平衡,即存在Ag+,D错误,答案选D。
Ag+(aq)+Cl-(aq),A正确;B.向AgCl中滴加0.1mol/LKI溶液,白色AgCl沉淀变为黄色AgI沉淀,B正确;C.向AgCl中滴加0.1mol/LKI溶液,白色AgCl沉淀变为黄色AgI沉淀,实验证明AgI比AgCl更难溶,C正确;D.滤液为AgCl的饱和溶液,也存在沉淀的溶解平衡,即存在Ag+,D错误,答案选D。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
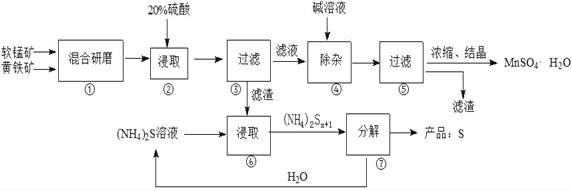
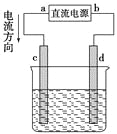
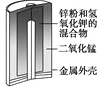
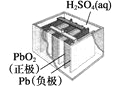
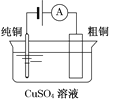
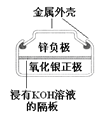
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag