题目内容
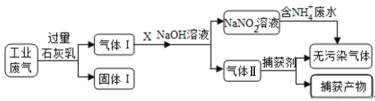
【题目】练江整治已刻不容缓,其中以印染工业造成的污染最为严重。某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO),设计了如下工业流程:
下列说法错误的是
A. 气体I中主要含有的气体有N2、NO、CO
B. X在反应中作氧化剂,可通入过量的空气
C. 处理含NH4+废水时,发生离子方程式是:NH4++NO2-=N2↑+2H2O
D. 捕获剂所捕获的气体主要是CO
【答案】B
【解析】
工业废气中CO2、SO2可被石灰乳吸收,生成固体I为CaCO3、CaSO3,气体I是不能被过量石灰乳吸收的N2、NO、CO,气体I通入气体X,用NaOH溶液处理后到的NaNO2,X可为空气,但不能过量,否则得到NaNO3,NaNO2与含有NH4+的溶液反应生成无污染气体,应生成N2,则气体II含有CO、N2,捕获剂所捕获的气体主要是CO,以此解答该题。
工业废气中CO2、SO2可被石灰乳吸收,生成固体I为CaCO3、CaSO3,气体I是不能被过量石灰乳吸收的N2、NO、CO,气体I通入气体X,用NaOH溶液处理后到的NaNO2,X可为空气,但不能过量,否则得到NaNO3,NaNO2与含有NH4+的溶液反应生成无污染气体,应生成氮气,则气体II含有CO、N2,捕获剂所捕获的气体主要是CO。
A.工业废气中CO2、SO2可被石灰乳吸收,生成CaCO3、CaSO3,因Ca(OH)2过量,则固体I为主要含有Ca(OH)2、CaCO3、CaSO3,气体I是不能被过量石灰乳吸收的N2、NO、CO,A正确;
B.由分析可知,气体I是不能被过量石灰水吸收的N2、NO、CO,气体I通入气体X,用氢氧化钠溶液处理后到的NaNO2,X可为空气,但不能过量,否则得到NaNO3,B错误;
C.NaNO2与含有NH4+的溶液反应生成无污染气体,应生成N2,发生氧化还原反应,离子方程式为NH4++NO2-=N2↑+2H2O, C正确;
D.气体II含有CO、N2,经捕获剂所捕获的气体主要是CO,D正确;
故答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】某学习小组探究稀HNO3、浓HNO3与铜的反应。
装置(尾气处理装置略) | 现象 |
| Ⅰ中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 |
Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 |
(1)试管Ⅰ中Cu与稀HNO3反应的化学方程式是________。
(2)Ⅱ中反应的速率比Ⅰ中的快,原因是________。
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;

假设2:溶解了生成的NO2。
探究如下:取Ⅱ中绿色溶液,分为两等份。
①取一份于如图所示装置中,_______(填“操作”和“现象”),证实Ⅱ中溶解了NO2。
②向另一份溶液加入_____(填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(4)对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释:
解释1.HNO3浓度越稀,溶液中NO3-的数目越少,被还原时,每个NO3-从还原剂处获得较多电子的机会_____(填“增多”或“减少”),因此被还原为更低价态。
解释2.推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
3NO2+H2O=2HNO3+NO

①B中盛放的试剂是________。
②C中盛放Cu(NO3)2和_________。
③该小组证实推测的合理性所依据的实验现象是________。