题目内容
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数的3倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X位于元素周期表的第____周期第__族,它的一种核素可测定文物年代,这种核素的符号是____。
(2)元素Y的原子结构示意图为___,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法_____。
(3)元素Z与元素T相比,非金属性较强的是___(用元素符号表示),下列表述中能证明这一事实的是___。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是____,理由______。
【答案】二 ⅣA 146C  取适量溶液于试管中,然后加入浓NaOH溶液,加热,若产生能使湿润的红色石蕊试纸变蓝的气体,可以证明该溶液中含有NH4+(答案合理即可) Cl b H2CO3 H2CO3是弱酸(或非氧化性酸)
取适量溶液于试管中,然后加入浓NaOH溶液,加热,若产生能使湿润的红色石蕊试纸变蓝的气体,可以证明该溶液中含有NH4+(答案合理即可) Cl b H2CO3 H2CO3是弱酸(或非氧化性酸)
【解析】
先根据元素的原子结构与性质判断T、X、Y、Z四种元素,然后根据各题要求分析解答。
T:M层电子数是K层电子数的3倍,K层排2个电子,L层排8个电子,M层排6个电子,所以是硫元素;
X:最外层电子数是次外层电子数的2倍,最外层电子数不超过8个,所以,次外层是K层,最外层是L层,K层排2个电子,L层排4个电子,所以是碳元素;
Y:常温下单质为双原子分子,其氢化物水溶液呈碱性,所以是氮元素;
Z:由最高正价为+7价,主族元素的族序数=其最外层电子数,且是短周期元素,氟没有正化合价,所以是氯元素。
(1)元素X是碳,位于元素周期表的第二周期ⅣA族,它的一种核素可测定文物年代,这种核素的符号是146C;
(2)N的原子结构示意图为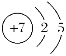 ,与氢元素可形成的一种离子是NH4+,检验NH4+的方法是取适量溶液于试管中,然后加入浓NaOH溶液,加热,若产生能使湿润的红色石蕊试纸变蓝的气体,可以证明该溶液中含有NH4+;
,与氢元素可形成的一种离子是NH4+,检验NH4+的方法是取适量溶液于试管中,然后加入浓NaOH溶液,加热,若产生能使湿润的红色石蕊试纸变蓝的气体,可以证明该溶液中含有NH4+;
(3)根据同周期非金属性质的变化规律及比较非金属性的方法来分析,Cl的非金属性比S元素强,Z的氢化物比T的氢化物稳定则说明Z的非金属性强,故答案为:Cl;b;
(4)T、X、Y、Z四种元素的最高价氧化物的水化物中H2CO3是弱酸,其他酸均为强酸,故答案为:H2CO3;弱酸。

 阅读快车系列答案
阅读快车系列答案【题目】仔细分析下列表格中烃的排列规律,判断排列在第15位烃的分子式是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | … |
C2H2 | C2H4 | C2H6 | C3H4 | C3H6 | C3H8 | C4H6 | C4H8 | C4H10 |
A.C6H14B.C6H12C.C7H12D.C7H14

