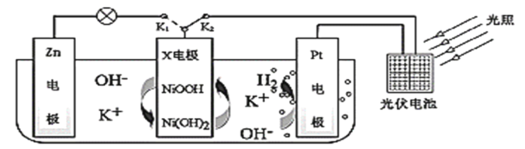
题目内容
【题目】某兴趣小组的同学做除去粗盐中不溶性杂质的实验,结合如图回答问题:
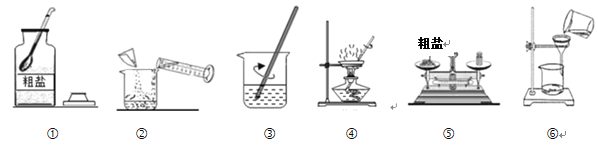
(1)完成操作⑥还缺少的仪器是__,该仪器在此实验中的作用是__。
(2)在操作④中,搅拌的目的是__,当观察到蒸发皿中___时,停止加热。热的蒸发皿应用___(填仪器名称)夹持放在石棉网上。
(3)完成该实验的操作先后顺序为___(填序号)、称量精盐并计算产率。
【答案】玻璃棒 引流 使受热均匀,防止液体飞溅 有较多固体析出 坩埚钳 ①⑤②③⑥④
【解析】
(1)过滤装置是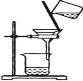 ;
;
(2)在操作④是蒸发,根据蒸发操作回答;
(3)粗盐提纯的步骤有溶解、过滤、蒸发、结晶;
(1)根据过滤装置图, 还缺少的仪器是玻璃棒,作用是引流;
还缺少的仪器是玻璃棒,作用是引流;
(2)在操作④是蒸发,蒸发过程中用玻璃棒搅拌,搅拌的目的是使受热均匀,防止液体飞溅,当观察到蒸发皿中有较多固体析出时,停止加热;热的蒸发皿应用坩埚钳夹持放在石棉网上。
(3)粗盐提纯的步骤有溶解、过滤、蒸发、结晶,完成该实验的操作先后顺序为①⑤②③⑥④,称量精盐并计算产率。

 阅读快车系列答案
阅读快车系列答案【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。查阅相关资料获悉:
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | — | 315 | — |
熔点/℃ | -70.0 | — | — | — |
升华温度/℃ | — | 180 | 300 | 162 |
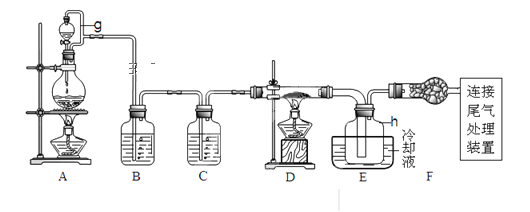
请回答下列问题:
(1)写出装置A中发生反应的离子方程式___。
(2)装置A中g管的作用是___;装置C中的试剂是___;装置E中的h瓶需要冷却理由是___。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质。为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+。
①写出用KMnO4滴定Fe2+的离子方程式:___;
②滴定前是否要滴加指示剂?___(填“是”或“否”),判断滴定终点的方法是___。
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是___。