题目内容
【题目】科学家预测第114号元素具有良好的力学、光学、电学等性质。下列对114号元素的叙述错误的是( )
A.该元素的位于第7周期第Ⅳ![]() 族,是金属元素
族,是金属元素
B.该元素的主要化合价为+2、+4
C.该元素的最高价氧化物有较强的氧化性
D.该元素的原子半径小于同主族其他元素的原子半径
【答案】D
【解析】
第七周期结束于118号元素,因此判断114号元素位于第七周期第ⅣA族,与铅元素在同一主族且在铅元素下方,与铅化学性质相似。
A.第7周期稀有气体元素的原子序数为118,可知114号元素位于第7周期第ⅣA族,为金属元素,故A正确;
B.第ⅣA族元素的主要化合价为+2、+4,故B正确;
C.最高价氧化物在化学反应中易得到电子,所以114号元素最高价氧化物有较强氧化性,故C正确;
D.该元素原子是第ⅣA族中电子层数最多的原子,故其在同主族元素原子中半径最大,故D错误;
答案选D。

【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。查阅相关资料获悉:
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | — | 315 | — |
熔点/℃ | -70.0 | — | — | — |
升华温度/℃ | — | 180 | 300 | 162 |
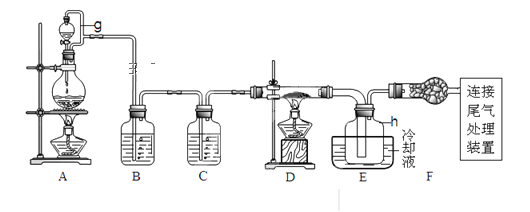
请回答下列问题:
(1)写出装置A中发生反应的离子方程式___。
(2)装置A中g管的作用是___;装置C中的试剂是___;装置E中的h瓶需要冷却理由是___。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质。为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+。
①写出用KMnO4滴定Fe2+的离子方程式:___;
②滴定前是否要滴加指示剂?___(填“是”或“否”),判断滴定终点的方法是___。
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2mol·L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是___。