题目内容
12.简答:在水溶液中,橙红色的$C{r}_{2}{O}_{7}^{2-}$与黄色的$Cr{O}_{4}^{2-}$有下列平衡关系:
$C{r}_{2}{O}_{7}^{2-}$+H2O?2$Cr{O}_{4}^{2-}$+2H+把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色.
(1)向上述溶液中加入NaOH溶液,溶液呈黄色,因为加入氢氧化钠溶液,使C(H+)减小,平衡右移,C(CrO42-)增大,C(Cr2O72-)减小.
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则溶液呈橙色,因为加入过量稀硫酸,使C(H+)增大,平衡左移C(Cr2O72-)增大,C(CrO42-)减小.
(3)向原溶液中逐滴加入Ba(NO3)2 溶液(已知BaCrO4为黄色沉淀),则平衡向右移动,溶液颜色将逐渐变为无色.
(4)已知$C{r}_{2}{O}_{7}^{2-}$与I-在酸性条件下可发生氧化还原反应:
①配平反应的离子方程式
$C{r}_{2}{O}_{7}^{2-}$+6I-+14H+=2Cr3++3I2+7H2O
②此反应中的氧化产物是I2 ,当消耗0.1mol K2Cr2O7时,共有0.6mol电子转移.
分析 (1)加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动;
(2)加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大;
(3)向原溶液中加入Ba(NO3)2溶液,生成BaCrO4沉淀,CrO42-浓度降低,结合平衡移动原理解答;
(4)①依据氧化还原反应电子守恒和电荷守恒、原子守恒配平书写离子方程式;
②还原剂反应中元素化合价升高失电子发生氧化反应生成氧化产物,结合离子方程式电子守恒计算得到电子转移;
解答 解:(1)加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动,平衡右移,C(CrO42-)增大,C(Cr2O72-)减小,溶液呈黄色,
故答案为:黄,加入氢氧化钠溶液,使C(H+)减小,平衡右移,C(CrO42-)增大,C(Cr2O72-)减小;
(2)增加生成物浓度平衡向逆反应方向移动,加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙色,
故答案为:橙,加入过量稀硫酸,使C(H+)增大,平衡左移C(Cr2O72-)增大,C(CrO42-)减小;
(3)向原溶液中加入Ba(NO3)2溶液,生成BaCrO4沉淀,CrO42-浓度降低,平衡正向移动,溶液的颜色变浅,
故答案为:向右移动,逐渐变为无色;
(4)①酸性的Cr2O72-可与过量的KI发生氧化还原反应生成I2,同时Cr2O72-被还原成Cr3+,即Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,
故答案为:1,6,14,2,3,7;
②元素化合价升高失电子发生氧化反应生成氧化产物,反应中碘元素化合价-1价变化为0价,被氧化生成氧化产物I2,Cr2O72-+6I-+14H+=2Cr3++7H2O+3I2,反应中碘元素化合价变化计算电子转移为6e-,所以当消耗0.1mol K2Cr2O7时电子转移0.6mol,
故答案为:I2,0.6 mol;
点评 本题考查化学平衡的影响因素,氧化还原反应电子转移计算和配平离子方程式方法,注意对化学平衡移动原理的理解,题目难度中等.

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案| A. | 容量瓶 | B. | 蒸发皿 | C. | 蒸馏烧瓶 | D. | 试管 |
| A. | 16 | B. | 14 | C. | 12 | D. | 28 |
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | |
| B. | H2C=CH2+Br2→CH3CHBr | |
| C. |  | |
| D. | CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3CH2CH3+H2O |
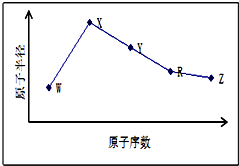 W、X、Y、Z、R是五种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10.X和Ne原子的核外电子数相差1.Y的最高价氧化物对应水化物是医用胃酸中和剂中的一种.R和W具有相同的最外层电子数.Z在同周期主族元素中原子半径最小.
W、X、Y、Z、R是五种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10.X和Ne原子的核外电子数相差1.Y的最高价氧化物对应水化物是医用胃酸中和剂中的一种.R和W具有相同的最外层电子数.Z在同周期主族元素中原子半径最小.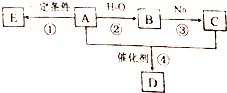 气体A是石油裂解的主要产物之一,其相对分子质量为28,C是一中气体,E是一种高分子化合物.A、B、C、D、E在一定条件下存在如图转化关系(部分反应条件、产物被省略)
气体A是石油裂解的主要产物之一,其相对分子质量为28,C是一中气体,E是一种高分子化合物.A、B、C、D、E在一定条件下存在如图转化关系(部分反应条件、产物被省略) (1)合成氨工业对国民经济和社会发展具有重要的 意义.某合成氨工业中氢气由天然气和水反应制备,其主要反应为:CH4(g)+2H2O (g)?CO2(g)+4H2(g)反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)
(1)合成氨工业对国民经济和社会发展具有重要的 意义.某合成氨工业中氢气由天然气和水反应制备,其主要反应为:CH4(g)+2H2O (g)?CO2(g)+4H2(g)反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”) Ⅰ.已知一个碳原子上连有两个羟基时,易发生下列转化.
Ⅰ.已知一个碳原子上连有两个羟基时,易发生下列转化.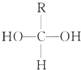 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$
 或
或