题目内容
【题目】氢溴酸在医药和石化工业上有广泛用途。如图是模拟工业制备氢溴酸粗品并精制流程:
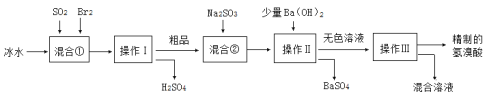
下列说法不正确的是
A.冰水的目的是降低反应温度,防止溴挥发,使反应更充分
B.混合①发生的反应为:SO2 +2H2O + Br2=H2SO4 + 2HBr
C.操作Ⅱ和操作Ⅲ的名称分别为过滤和蒸馏
D.Na2SO3的作用是调节溶液的pH也可以用Na2CO3替代
【答案】D
【解析】
A. 溴易挥发,冰水的目的是降低反应温度,防止溴挥发,使反应更充分,A正确;
B. 目标产物为HBr,可通过SO2 和Br2发生氧化还原反应生成,故混合①发生的反应为:SO2 +2H2O + Br2=H2SO4 + 2HBr,B正确;
C. 操作Ⅱ为过滤,除去硫酸钡沉淀后得滤液,滤液中是含有HBr和NaBr等的混合溶液,经过蒸馏得到目标产物,C正确;
D. Na2SO3的作用是通过氧化还原反应去除残留的溴,不可以用Na2CO3替代,D不正确;
答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目