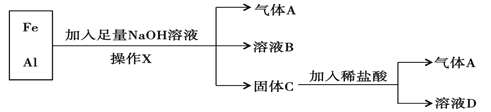
题目内容
【题目】合成氨在工业生产中具有重要意义。
(1)在合成氨工业中I2O5常用于定量测定CO的含量。己知2I2(s)+5O2(g)=2I2O5(s) △H=-76kJ·mol-1;2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1。则该测定反应的热化学方程式为____________________________________。
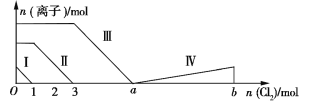
(2)不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数φ (CO2)随时间t变化曲线如图。
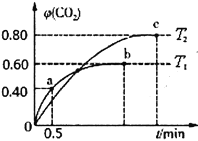
①温度T1时,0~0.5 min内的反应速率v(CO)=________________。
②b点CO的平衡转化率α为____________,c点的平衡常数K为________________。
③下列措施能提高该反应CO转化率的是________(填字母)
a.升高温度 b.增大压强 c.加入催化剂 d.移走CO2
(3)若氨水与SO2恰好生成正盐,则此时溶液呈_________(填“酸性”或“碱性”),向上述溶液中通入___________(填“NH3”或“SO2”)可使溶液呈中性,此时溶液中含硫微粒浓度的大小关系为________________。(已知常温下NH3·H2O的Kb=1.8×10-5mol·L-1,H2SO3的Ka1=1.5×10-2mol·L-1,Ka2=6.3×10-8mol·L-1)
【答案】 5CO(g)+ I2O5(s)=5CO2(g)+ I2(s) H=﹣1377kJ· mol-1 1.6mol·L-1·min-1 60% 1024 d 碱性 SO2 c(HSO3-)>c(SO32-)>c(H2SO3)
【解析】(1)反应①×(-1/2)+②×5/2得到:5CO(g)+ I2O5(s)=5CO2(g)+ I2(s) H=﹣1377kJ· mol-1。
(2)①反应体系只有CO2和CO,通入4molCO,根据C守恒得到:CO2和CO的物质的量之和为4mol。CO2的体积分数为0.4,即CO2为4×0.4=1.6mol,所以v(CO)=v(CO2)=1.6/(2×0.5)= 1.6mol·L-1·min-1。
②由上b点的CO2为4×0.6=2.4mol,说明反应的CO也是2.4mol,转化率为2.4÷4=60%。由上c点的CO2为4×0.8=3.2mol,CO为0.8mol。所以反应的平衡常数为k=3.25/0.85=1024。
③反应放热升高温度平衡逆向移动,转化率下降,选项a错误。增大压强平衡不移动,选项b错误。加入催化剂平衡不移动,选项c错误。移走二氧化碳,减小生成物浓度,平衡正向移动,转化率升高,选项d正确。
(3)若氨水与SO2恰好生成正盐,则此时溶液为(NH4)2SO3的溶液,其中NH4+的水解常数为:![]() 。SO32-的水解常数为:
。SO32-的水解常数为: ![]() 。由上说明亚硫酸根离子的水解应该远大于铵根离子的水解,所以溶液显碱性。注意:因为亚硫酸根离子的水解常数远大于铵根离子的水解常数,所以即使溶液中的铵根离子浓度大约是亚硫酸根离子浓度的2倍,也不应该溶液显碱性。因为溶液显碱性,所以通入二氧化硫才能使溶液显中性。根据电离平衡常数的表达式有:
。由上说明亚硫酸根离子的水解应该远大于铵根离子的水解,所以溶液显碱性。注意:因为亚硫酸根离子的水解常数远大于铵根离子的水解常数,所以即使溶液中的铵根离子浓度大约是亚硫酸根离子浓度的2倍,也不应该溶液显碱性。因为溶液显碱性,所以通入二氧化硫才能使溶液显中性。根据电离平衡常数的表达式有:![]()
![]() ,溶液显中性,所以有:
,溶液显中性,所以有:![]() ,
,![]() ,所以有:c(HSO3-)>c(SO32-)>c(H2SO3)。
,所以有:c(HSO3-)>c(SO32-)>c(H2SO3)。