��Ŀ����
����Ŀ��SO2��CO��CO2��NOx�ǶԻ���Ӱ��ϴ�ļ������壬�����ǵĺ������ƺ��������Ż��������滷������Ч;����
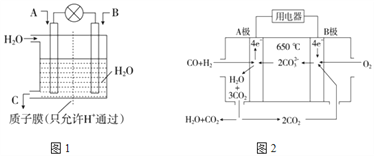
��1�����õ绯ѧԭ����CO��SO2ת��Ϊ��Ҫ����ԭ�ϣ�װ����ͼ1��ʾ��
����AΪCO��BΪH2��CΪCH3OH����ͨ��CO��Ϊ_________��(����������������)��
����AΪSO2��BΪO2��CΪH2SO4�����ĵ缫��ӦʽΪ��___________________________��
��2��̼����ȼ�ϵ�أ���һ������Li2CO3��Na2CO3���ۻ����Ϊ����ʣ������¶�Ϊ650�����ڴ��¶�������Ϊ��������ú����CO��H2�������Ϊ1��1��ֱ����ȼ�ϣ��乤��ԭ����ͼ2��ʾ��
������ܷ�ӦΪ____________________________________________��
���Դ˵�Դ�����������������Һ�����������������Ϊ21.6g��������Һ���Ϊ2L����Һ��pHԼΪ___________��
��3��ij�о�С����������װ����N2O4��������������N2O5��
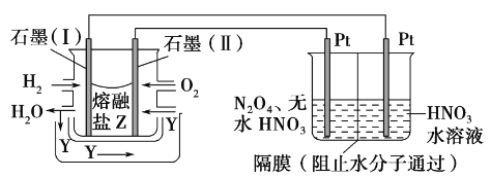
������H2��O2��������Na2CO3���ȼ�ϵ�أ����õ�ⷨ�Ʊ�N2O5��װ����ͼ��ʾ������YΪCO2���ڸõ缫��ͬʱ������CO2��Ŀ����__________________________��
���������У�����N2O5�ĵ缫��Ӧ����ʽΪ_________________________________________��
���𰸡� �� SO2+2H2O-2e-=SO42-+ 4H+ CO+H2+O2=CO2+H2O 1 �������ԺͶ�����̼��ͬת��Ϊ̼������ӣ����������εijɷֲ��� N2O4+2HNO3-2e-=2N2O5+2H+
��������(1)��ȼ�ϵ���У�ͨ���������ĵ缫��������ͨ�뻹ԭ���ĵ缫�Ǹ������÷�Ӧ��CԪ�ػ��ϼ���+2�۱�Ϊ-2�ۡ�HԪ�ػ��ϼ���0�۱�Ϊ+1�ۣ�����CO������������ͨ��CO�ĵ缫Ϊ�������ʴ�Ϊ������
����AΪSO2��BΪO2��CΪH2SO4�������϶�������ʧ���Ӻ�ˮ��Ӧ������������Ӻ������ӣ��缫��ӦʽΪSO2+2H2O-2e-=SO42-+4H+���ʴ�Ϊ��SO2+2H2O-2e-=SO42-+4H+��
(2)�ٸ�ȼ�ϵ���У�������һ����̼������ʧ���Ӻ�̼������ӷ�Ӧ���ɶ�����̼��ˮ���������������õ��ӵĻ�ԭ��Ӧ������ܷ�ӦΪһ����̼��������������Ӧ���ɶ�����̼��ˮ���ܷ�Ӧ����ʽΪ��CO+H2+O2=CO2+H2O���ʴ�Ϊ��CO+H2+O2=CO2+H2O��
�ڵ����������������Һ������Ϊ������ʧ�������������������Ϸ�����Ӧ��Ag++e-=Ag�����������Ϊ21.6g��0.2mol��ת�Ƶ�����0.2mol���������ϣ�4OH--4e-=2H2O+O2�����������������ʵ�����0.05mol�������1.12L�������������������ʵ���Ϊ0.2mol������Һ��������Ϊ0.2mol��c(H+)=![]() =0.1mol/L��������Һ��pHΪ1���ʴ�Ϊ��1��
=0.1mol/L��������Һ��pHΪ1���ʴ�Ϊ��1��
(3)���������ϣ������õ������ɵ������ӿ��ԺͶ�����̼���Ϊ̼������ӣ����Ա��������εijɷֲ��䣬�ʴ�Ϊ���������ԺͶ�����̼��ͬת��Ϊ̼������ӣ����Ա��������εijɷֲ��䣻
��N2O5�е�Ԫ�صĻ��ϼ���+5�ۣ��������е�Ԫ��Ҳ��+5�������Ӧ�����������N2O5�����������������ɣ��ݵ缫��Ӧ���ӷŵ�˳���֪����������2H++2e-=H2���ķ�Ӧ��������ΪN2O4+2HNO3-2e-=2N2O5+2H+���ʴ�Ϊ��N2O4+HNO3-2e-=2N2O5+2H+��

 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�


