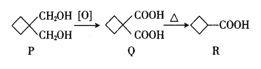
题目内容
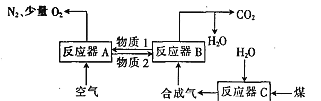
【题目】由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝,工艺流程如图1:
(已知:NaCl熔点为801℃;AlCl3在181℃升华;固体直接变为气体叫做升华)
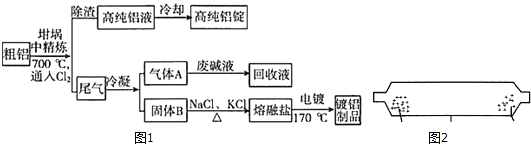
(1)把NaCl和AlCl3的固体混合物置于如图2所示的装置的一端,加热到___(最低温度)℃,即可分离NaCl和AlCl3
(2)将Cl2连续通入坩埚中的粗铝熔体里,杂质随气泡上浮除去气泡的主要成分除Cl2外还含有___;固态杂质黏附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在的物质是___。
(3)用废碱液处理气体A的过程中,所发生反应的离子方程式有:①H++OH-=H2O,②___
(4)镀铝电镀池中,金属铝为阳极,熔融盐电镀池中存在Na+K+______等离子钢材表面(电极)的电极反应式为AlCl4-+3e-=Al+4Cl-或___
(5)钢材镀铝后,在表面氧化成致密的___,避免钢材接触空气而防止钢材被腐蚀。
【答案】181 H2、HCl、AlCl3 NaCl Cl2+2OH-=Cl-+ClO-+H2O ![]()
![]()
![]() 氧化铝膜
氧化铝膜
【解析】
粗铝![]() 通入氯气在坩埚中精炼,将
通入氯气在坩埚中精炼,将![]() 连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除
连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除![]() 外还含有
外还含有![]() 、HCl、
、HCl、![]() ,除渣(氯化钠)后得到高纯铝液和尾气,高纯铝液冷却得到高纯铝锭,尾气冷凝得到气体A为
,除渣(氯化钠)后得到高纯铝液和尾气,高纯铝液冷却得到高纯铝锭,尾气冷凝得到气体A为![]() ,废碱液回收得到回收液;B固体加入氯化钠和氯化钾加热得到熔融盐,电镀得到镀铝制品,据此来分析即可。
,废碱液回收得到回收液;B固体加入氯化钠和氯化钾加热得到熔融盐,电镀得到镀铝制品,据此来分析即可。
(1)![]() 熔点为
熔点为![]() ;
;![]() 在
在![]() 升华,把NaCl和
升华,把NaCl和![]() 的固体混合物置于如图所示的装置的一端,加热到
的固体混合物置于如图所示的装置的一端,加热到![]() 氯化铝升华变为气体,氯化铝气体在另一端冷凝,从而分离了氯化钠和氯化铝;
氯化铝升华变为气体,氯化铝气体在另一端冷凝,从而分离了氯化钠和氯化铝;
(2)粗铝含有一定量的金属钠和氢气,钠、铝和氯气反应生成了氯化钠和氯化铝,氢气和氯气发生反应生成氯化氢,其中氯化钠熔点为![]() ,较高,是固态杂质黏附于气泡上,气泡的主要成分除
,较高,是固态杂质黏附于气泡上,气泡的主要成分除![]() 外还含有
外还含有![]() 、HCl、
、HCl、![]() ;
;
(3)根据分析A中有氯气以及氯化氢,均能和烧碱反应,用于尾气处理,因此写出氯气与碱液反应的离子方程式即可:![]() ,氯化氢与碱的反应已经给出;
,氯化氢与碱的反应已经给出;
(4)电镀池中镀件金属铝作阳极,金属铝失电子发生氧化反应,熔融盐电镀池中存在![]() 等离子,钢材做阴极得电子,表面
等离子,钢材做阴极得电子,表面![]() 电极
电极![]() 的电极反应式为:
的电极反应式为:![]() 或
或![]() ;
;
(5)铝金属表面形成的致密氧化铝膜具有保护作用,致密的氧化膜能隔绝钢材与空气中的![]() 和
和![]() 的接触,使电化学腐蚀和化学腐蚀不能发生。
的接触,使电化学腐蚀和化学腐蚀不能发生。

【题目】I.CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体中CH4与CO2的分子个数比为_________;
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
II.根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④__________ | ⑤Na2SO4 ⑥K2CO3 | ⑦SO2 ⑧Na2O | ⑨HCl ⑩________ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的弱电解质,将化学式分别填在表中②、④、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为_______;
(3)将⑧的固体加入①的稀溶液中,反应的离子方程式为_______________;
(4)下列关于氧化物的叙述,正确的是_________。
A.金属氧化物一定属于碱性氧化物
B.碱性氧化物一定属于金属氧化物
C.非金属氧化物一定属于酸性氧化物
D.酸性氧化物一定属于非金属氧化物
(5)下列关于酸、碱、盐元素组成的说法中,正确的是_________。
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素