题目内容
【题目】X、Y、Z、R为前四周期元素,原子序数依次增大。X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满。请回答下列问题:
(1)Z3+离子的核外电子排布式是_______。
(2)科学家成功地在高压下将XY2转化为具有类似SiO2结构的原子晶体,该晶体中X原子的杂化轨道类型是_______;X、Z、R的单质分别与足量Y2充分反应所得产物的熔点由高到低的顺序是_______。(填化学式)
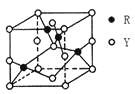
(3)由Y、R形成的某化合物的晶胞结构如图所示,其化学式是_______。
(4)常温下,pH相同的NaZY2与Na2XY3两种溶液,物质的量浓度较大的是_______。(填化学式)
(5)将亚硫酸钠的水溶液逐滴加入RCl2的水溶液中,再加入少量浓盐酸混匀,得到难溶的白色沉淀RCl,该反应的离子方程式是_______。
【答案】1s22s2sp6 sp3 Al2O3>CuO>CO2 CuO Na2CO3 SO32-+2Cu2++2Cl-+H2O=2CuCl↓+SO42-+2H+
【解析】
X、Y、Z、R为前四周期元素,原子序数依次增大,X、Y同周期,X基态原子的最外层电子数是次外层的2倍,其次外层电子数是2,则X是C元素,Y基态原子的s能级和p能级上电子数相等,则Y是O元素;Z是地壳中含量最高的金属元素,为Al元素;R+离子的3d轨道全充满,则R是Cu元素,据此解答。
(1)Z是Al元素,Al失去3个电子生成铝离子,根据构造原理书写铝离子核外电子排布式为1s22s2sp6;
(2)该二氧化碳为原子晶体,每个C原子和4个Si原子形成4个共价键,为sp3杂化;X、Z、R的单质分别与足量Y2充分反应所得产物分别是二氧化碳、氧化铝和CuO,氧化铝是原子晶体、CuO是离子晶体、二氧化碳是分子晶体,熔沸点高低顺序是:原子晶体>离子晶体>分子晶体,所以晶体熔沸点高低顺序是Al2O3>CuO>CO2;
(3)该晶胞中Cu离子个数=4,氧离子个数=8×1/8+6×1/2=4,铜离子和氧离子个数之比=4:4=1:1,其化学式为CuO;
(4)常温下,pH相同的NaAlO2与Na2CO3两种溶液,偏铝酸根离子水解程度大于碳酸根离子,所以pH相同时碳酸钠浓度较大;
(5)盐酸、亚硫酸根离子和铜离子发生氧化还原反应生成CuCl白色沉淀、硫酸根离子,离子方程式为SO32-+2Cu2++2Cl-+H2O=2CuCl↓+SO42-+2H+。

【题目】I.CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体中CH4与CO2的分子个数比为_________;
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
II.根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④__________ | ⑤Na2SO4 ⑥K2CO3 | ⑦SO2 ⑧Na2O | ⑨HCl ⑩________ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的弱电解质,将化学式分别填在表中②、④、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为_______;
(3)将⑧的固体加入①的稀溶液中,反应的离子方程式为_______________;
(4)下列关于氧化物的叙述,正确的是_________。
A.金属氧化物一定属于碱性氧化物
B.碱性氧化物一定属于金属氧化物
C.非金属氧化物一定属于酸性氧化物
D.酸性氧化物一定属于非金属氧化物
(5)下列关于酸、碱、盐元素组成的说法中,正确的是_________。
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素