题目内容
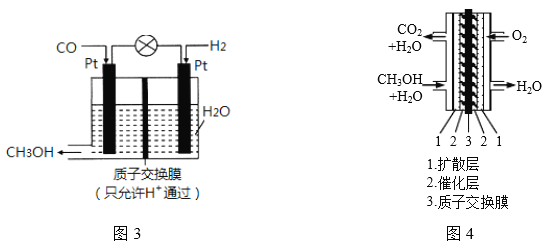
【题目】向NaOH和Na2CO3混合溶液中滴加0.1molL﹣1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A.在0﹣a范围内,只发生中和反应
B.ab段发生反应的离子方程式为:CO32-+2H+=CO2↑+H2O
C.a=0.3
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
【答案】C
【解析】
NaOH和Na2CO3混合溶液,滴加盐酸时,先发生氢氧化钠与盐酸的中和反应,再发生碳酸铵与盐酸的反应生成碳酸氢钠和氯化钠,最后碳酸氢钠与盐酸反应产生二氧化碳,利用物质的量关系进行解答。
A.在0﹣a范围内,先发生氢氧化钠与盐酸的中和反应,再发生碳酸铵与盐酸的反应生成碳酸氢钠和氯化钠,A错误;
B.ab段发生反应为碳酸氢钠与盐酸,离子方程式为:HCO32-+H+=CO2↑+H2O,B错误;
C.根据碳元素守恒,碳酸氢钠的物质的量为0.01mol,即碳酸氢钠与盐酸反应中消耗盐酸0.01mol,需要0.1molL﹣1稀盐酸体积为0.1L,即a=0.4-0.1=0.3,C正确;
D.根据碳元素守恒,碳酸氢钠的物质的量为0.01mol,即碳酸钠的物质的量为0.1mol,NaOH和Na2CO3混合溶液共消耗盐酸0.3mol,即原混合溶液中NaOH与Na2CO3的物质的量之比为2:1,D错误;
答案为C。

【题目】POC13常用作半导体掺杂剂及光导纤维原料,实验室制备POC13并测定产品含量的实验过程如下:
I.实验室制备POC13。采用氧气氧化液态PCl3法制取POC13,实验装置(加热及夹持仪器略)如下图:
资料:①Ag++SCN-=AgSCN↓ Ksp(AgCl)>Ksp(AgSCN);

②PCl3和POC13的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POC13 | 2.0 | 106.0 | 153.5 |
(1)仪器a的名称____________________。
(2)B中所盛的试剂是________,干燥管的作用是_____________________。
(3)POC13遇水反应的化学方程式为____________________________。
(4)反应温度要控制在60~65℃,原因是:____________________________。
II.测定POC13产品的含量。实验步骤:
①制备POC13实验结束后,待三颈瓶中的液体冷却至室温,准确称取29.1g产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
②取10.00 mL溶液于锥形瓶中,加入20.00 mL 3.5mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用1.00mol/LKSCN溶液滴定过量AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。
(5)步骤④中X可以选择___________________ 。
(6)步骤③若不加入硝基苯,会导致测量结果______(填偏高,偏低,或无影响)
(7)反应产物中POC13的质量百分含量为___________________, 若滴定终点,读取KSCN溶液俯视刻度线,则上述结果____________(填偏高,偏低,或无影响)
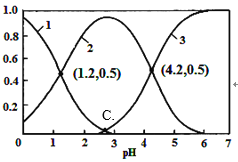
【题目】以黄铜矿(主要成分为 CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要工艺流程如下:
已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表。
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
下列说法不正确的是
A. 试剂a可以是CuO或Cu(OH)2,作用是调节pH至3.7~4.7之间
B. 反应I的化学反应方程式为4 CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O,该反应中铁元素被还原
C. 操作X为蒸发浓缩至溶液表面出现晶膜,再冷却结晶
D. 反应Ⅲ的离子方程式为Cu2++Fe==Cu+Fe2+,试剂c参与反应的离子方程式分别为Fe+2H+=Fe2++H2↑,Fe(OH)3+3H+=Fe 3++3H2O
【题目】甲醇CH3OH)是一种重要的化工原料,工业上有多种方法可制得甲醇成品
(一)以CO、H2和CO2制备甲醇
①CO2(g)+H2(g)![]() COg)+H2O(g) H1
COg)+H2O(g) H1
②CO(g)+2H2 (g) ![]() CH3OH(g) △H2
CH3OH(g) △H2
③CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) H3
CH3OH(g)+H2O(g) H3
(1)已知:反应①的化学平衡常数K和温度的关系如下表
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
则下列说法正确的是______
A.反应①正反应是吸热反应
B.一定体积的密闭容器中,压强不再变化时,说明反应①达到平衡状态
C.1100℃时,反应①的K可能为1.5
D.在1000℃时,[c(CO2)·c(H2)]/[c(CO)·c(H2O)]约为0.59
(2)比较△H2_____△H3(填“>”、“=”或“<”)
(3)现利用②和③两个反应合成CH3OH,已知CO可使反应的催化剂寿命下降若氢碳比表示为f=[n(H2)-n(CO2)]/[n(CO)+n(CO2)],则理论上f=_____时,原料气的利用率高,但生产中住往采用略高于该值的氯碳比,理由是_________________________________.
(二)以天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2Og) ![]() CO(g)+3H2(g) H1>0
CO(g)+3H2(g) H1>0
(ii)合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) H2>0
CH3OH(g) H2>0
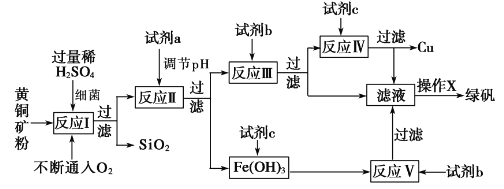
在一定压强下,1 mol CH4(g)和1 mol H2O(g)在三种不同催化剂作用下发生反应(i),经历相同时间时,CO的物质的量(n)随温度变化的关系如图1
(1)下列说法正确的是_______
A.曲线①中n(CO)随温度变化的原因是正反应为吸热反应,升高温度,平衡向右移动
B.三种催化剂中,催化剂③的催化效果最好,所以能获得最高的产率
C.当温度低于700℃时的曲线上的点可能都没有到达平衡
D.若温度大于700℃时,CO的物质的量保持不变
(2)500℃时,反应(1)在催化剂①的作用下到10mim时达到平衡,请在图2中画出反应(1)在此状态下0至12分钟内反应体系中H2的体积分数![]() (H2)随时间t变化的总趋势___________________
(H2)随时间t变化的总趋势___________________
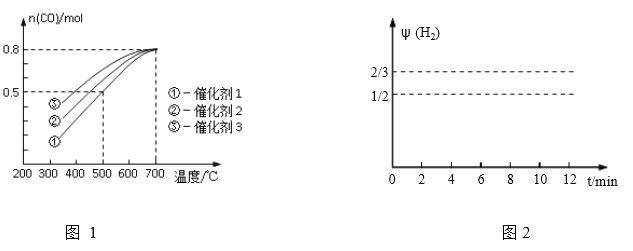
(三)研究表明,CO也可在酸性条件下通过电化学的方法制备甲醇,原理如图3所示。
(1)产生甲醇的电极反应式为___________________;
(2)甲醇燃料电池应用很广,其工作原理如图4,写出电池工作时的负极反应式:___________。