题目内容
10.根据反应3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O回答下列问题:(1)用单线桥法标明电子转移方向和数目
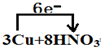 ═3Cu(NO3)2+2NO↑+4H2O,还原剂是Cu,氧化剂是硝酸;(填化学式)
═3Cu(NO3)2+2NO↑+4H2O,还原剂是Cu,氧化剂是硝酸;(填化学式)(2)硝酸在反应中的既体现出氧化性和酸性;
(3)当转移4.5mol电子时,有1.5molHNO3被还原,产生NO的体积(标准状况)33.6L;
(4)该反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
分析 氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目,化合价降低元素所在的反应物是氧化剂,化合价升高元素所在的反应物是还原剂,8HNO3+3Cu═3Cu(NO3)2+2NO↑+4H2O反应中,Cu元素的化合价由0升高为+2价,N元素的化合价由+5价降低为+2价,以此来解答.
解答 解:(1)氧化还原反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中失电子的元素是铜元素,化合价升高,得电子的元素是氮元素,化合价降低,转移的电子数目为6mol,电子转移情况为: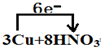 ═3Cu(NO3)2+2NO↑+4H2O,硝酸是氧化剂,Cu是还原剂,
═3Cu(NO3)2+2NO↑+4H2O,硝酸是氧化剂,Cu是还原剂,
故答案为: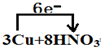 ═3Cu(NO3)2+2NO↑+4H2O;Cu;HNO3;
═3Cu(NO3)2+2NO↑+4H2O;Cu;HNO3;
(2)氧化还原反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,8mol硝酸参与反应,只有2mol化合价降低,所以硝酸在反应中的既体现出氧化性和酸性,
故答案为:氧化性和酸;
(3)由方程式可知当有2mol HNO3被还原时,3molCu被氧化,转移6mol电子,所以当转移4.5mol电子时,有 $\frac{4.5}{6}$×2=1.5molHNO3被还原,产生NO的体积(标准状况)1.5×22.4=33.6L,故答案为:1.5;33.6L;
(4)该反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从元素化合价角度分析,题目难度不大.

练习册系列答案
相关题目
20.将2.0mol SO2气体和2.0mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)?2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
| A. | 1.6 mol SO2+0.3 mol O2+0.4 mol SO3 | |
| B. | 3.0 mol SO2+0.5 mol O2+1.0 mol SO3 | |
| C. | 3.0 mol SO2+1.0 mol O2+1.0 mol SO3 | |
| D. | 4.0 mol SO2+1.0 mol O2+0.1 mol SO3 |
18.在无土培植中,需用0.5mol•L-1NH4Cl、0.16mol•L-1KCl、0.24mol•L-1 K2SO4的营养液,若用KCl、NH4Cl、(NH4)2SO4三种固体配制1L营养液,则需此三种固体的物质的量为( )
| A. | 0.4 mol 0.5 mol 0.12 mol | B. | 0.64 mol 0.02 mol 0.24 mol | ||
| C. | 0.64 mol 0.5 mol 0.24 mol | D. | 0.66 mol 0.5 mol 0.24 mol |
2.下列关于水玻璃的性质和用途的叙述中正确的是( )
| A. | 它是一种纯净物,既不燃烧也不易腐蚀 | |
| B. | 水玻璃是生产玻璃的主要原料之一 | |
| C. | 木柴、织物浸过水玻璃具有防腐性能且不易燃烧 | |
| D. | 水玻璃的化学性质稳定,在空气中不易变质 |
9.有机物是含碳的化合物,下列化合物中不是有机物的是( )
| A. | CO2 | B. | CCl4 | C. | C4H8 | D. | CH3OH |
7.物质的量浓度相同的三种正盐NaX、NaY、NaZ的水溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
| A. | HX,HZ,HY | B. | HX,HY,HZ | C. | HZ,HY,HX | D. | HY,HZ,HX |