题目内容
5.已知实验室制取Cl2的反应为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成Cl2:(1)写出PbO2与浓盐酸反应的化学方程式PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O,其中表现还原性的HCl与表现酸性的HCl的物质的量之比为1:1;
(2)PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO.若加热分解后所得到的固体全部为Pb3O4,现将amolPbO2加热分解,则加热过程中放出O2$\frac{112a}{15}$L(标准状况下);
(3)现将1mol PbO2加热分解,所得固体中,pb2+占Pb元素的物质的量分数为x,则向加热所得固体中再加入足量的浓盐酸,收集产生的Cl2的物质的量为(1-x)mol.
分析 (1)由题意可知,PbO2与浓盐酸反应生成PbCl2、Cl2与H2O,发生还原反应的HCl生成氯气,表现酸性的HCl生成PbCl2;
(2)根据Pb原子守恒计算n(Pb3O4),根据氧原子守恒计算生成氧气物质的量,再根据V=nVm计算氧气体积;
(3)计算+4价Pb的物质的量,根据电子转移守恒计算生成氯气物质的量.
解答 解:(1)由题意可知,PbO2与浓盐酸反应生成PbCl2、Cl2与H2O,反应方程式为:PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O,发生还原反应的HCl生成氯气,表现酸性的HCl生成PbCl2,反应中表现还原性的HCl与表现酸性的HCl的物质的量之比为1:1,
故答案为:PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;1:1;
(2)根据Pb原子守恒,n(Pb3O4)=$\frac{1}{3}$n(PbO2)=$\frac{a}{3}$mol,根据氧原子守恒,生成氧气物质的量=$\frac{amol×2-\frac{a}{3}mol×4}{2}$=$\frac{a}{3}$mol,标况下氧气体积为$\frac{a}{3}$mol×22.4L/mol=$\frac{112a}{15}$L,
故答案为:$\frac{112a}{15}$;
(3)+4价Pb的物质的量1mol×(1-x)=(1-x)mol,根据电子转移守恒,生成氯气物质的量为$\frac{(1-x)mol×(4-2)}{2}$=(1-x)mol,
故答案为:(1-x)mol.
点评 本题考查氧化还原反应有关计算,侧重考查学生分析计算能力,难度中等.

| A. | 研究物质的变化 | B. | 制造新物质 | ||
| C. | 认识分子和制造分子 | D. | 做实验 |
| A. | 依据能否电离出H+,可将化合物分为酸等 | |
| B. | 依据反应是否有离子参加或生成,可将化学反应分为离子反应和非离子反应 | |
| C. | 依据分散质粒子直径的大小,将分散剂为液体的分散系分为溶液、胶体、浊液 | |
| D. | 依据组成元素的种类,将纯净物分为单质和化合物 |
| A. | 啤酒 | B. | 葡萄酒 | C. | 白酒 | D. | 黄酒 |
| A. | 等物质的量浓度的氨水和盐酸等体积混合后的溶液:c(H+)=c(OH-)+c (NH3•H2O) | |
| B. | 浓度为0.1mol•L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) |
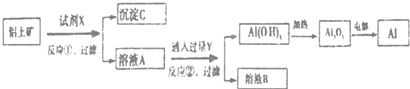
下列叙述正确的是( )
| A. | 反应①中试剂X是氢氧化钠溶液 | |
| B. | 试剂Y是HCI,它与AlO2-反应生成氢氧化铝 | |
| C. | 图中所示转化反应中包含2个氧化还原反应 | |
| D. | 将X与Y试剂进行对换,最终可以达到相同结果 |
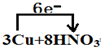 ═3Cu(NO3)2+2NO↑+4H2O,还原剂是Cu,氧化剂是硝酸;(填化学式)
═3Cu(NO3)2+2NO↑+4H2O,还原剂是Cu,氧化剂是硝酸;(填化学式)