题目内容
6.下列事实一定能说明HNO2为弱电解质的句数是( )①常温时NaNO2溶液的pH大于7;
②用HNO2溶液做导电实验,灯泡很暗;
③HNO2与NaCl不能反应;
④常温下0.1mol•L-1的HNO2溶液pH=2;
⑤1L pH=1的HNO2溶液加水稀释至100L后溶液的pH=2.2;
⑥1L pH=1的HNO2溶液和1L pH=1的盐酸分别与足量的NaOH溶液完全反应,最终HNO2消耗的NaOH多;
⑦HNO2溶液中加入一定量的NaNO2晶体,溶液中c(OH-)增大;
⑧HNO2溶液中加水稀释,溶液中c(OH-)增大.
| A. | 4句 | B. | 5句 | C. | 6句 | D. | 7句 |
分析 只有部分电离的电解质为弱电解质,只要能说明亚硝酸部分电离或亚硝酸根离子能够水解,就能证明亚硝酸是弱电解质,据此分析解答.
解答 解:①常温时NaNO2溶液的pH大于7,说明亚硝酸钠是强碱弱酸盐,亚硝酸根离子水解而使其溶液呈碱性,则亚硝酸部分电离,为弱电解质,故正确;
②用HNO2溶液做导电实验,灯泡很暗,说明溶液中离子浓度较低,但不能水解亚硝酸部分电离,所以不能证明亚硝酸是弱电解质,故错误;
③HNO2与NaCl不能反应,说明二者混合不具备复分解反应的条件,但不能说明亚硝酸部分电离,所以不能证明亚硝酸是弱电解质,故错误;
④常温下0.1mol•L-1的HNO2溶液pH=2,说明亚硝酸部分电离,为弱电解质,故正确;
⑤1L pH=1的HNO2溶液加水稀释至100L后溶液的pH=2.2,说明亚硝酸中存在电离平衡,所以能证明亚硝酸是弱电解质,故正确;
⑥1L pH=1的HNO2溶液和1L pH=1的盐酸分别与足量的NaOH溶液完全反应,最终HNO2消耗的NaOH多,说明亚硝酸中存在部分电离,所以能证明亚硝酸是弱电解质,故正确;
⑦HNO2溶液中加入一定量的NaNO2晶体,溶液中c(OH-)增大,说明亚硝酸存在电离平衡,加入亚硝酸钠,增大了亚硝酸根离子的浓度,平衡逆向移动,故正确;
⑧酸溶液加水稀释,酸性减弱,溶液中c(OH-)增大,不能证明存在电离平衡,故错误;
所以正确的有①④⑤⑥⑦,故选B.
点评 本题考查强弱电解质的判断,为高考高频点,强弱电解质的根本区别是其电离程度,与溶液导电性强弱无关,溶液导电性与离子浓度有关,易错选项是③.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
9.油脂在人体内水解最终生成高级脂肪酸和( )
| A. | 乙醇 | B. | 葡萄糖 | C. | 甘油 | D. | 氨基酸 |
1.常温下,下列溶液中各离子浓度关系正确的是( )
| A. | 等物质的量浓度的氨水和盐酸等体积混合后的溶液:c(H+)=c(OH-)+c (NH3•H2O) | |
| B. | 浓度为0.1mol•L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) |
15.同温同压下有两份体积相同的O2和O3,关于它们的叙述正确的是( )
| A. | 分子数之比是1:1 | B. | 原子个数比是3:2 | C. | 质子数比是 3:2 | D. | 密度之比是1:1 |
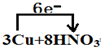 ═3Cu(NO3)2+2NO↑+4H2O,还原剂是Cu,氧化剂是硝酸;(填化学式)
═3Cu(NO3)2+2NO↑+4H2O,还原剂是Cu,氧化剂是硝酸;(填化学式)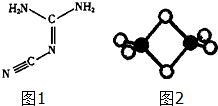 双氰胺结构简式如图1.
双氰胺结构简式如图1.
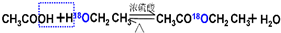 ,
, .
.