题目内容
9.请根据题意,选择恰当的选项用字母代号填空.(1)根据如表左边的“实验操作”,从右边的“实验现象”中选择正确的字母代号,填人对应“答案”的空格中.
| 实验操作 | 答案 | 实验现象 |
| ①向鸡蛋清溶液里加入饱和硫酸铵溶液 | A.呈蓝色 B.呈黄色 C、析出白色沉淀 D.出现光亮的银镜 | |
| ②向银氨溶液中加人葡萄糖溶液后水浴加热 | ||
| ③向鸡蛋清溶液里滴加浓硝酸后微热 | ||
| ④向士豆片上滴加碘水 |
①可以作为水果催熟剂的是D; ②富含乙醇的是C;
③在潮湿的空气中会生锈的是A; ④富含蛋白质的是B.
(3)青霉素是最重要的抗生素.青霉素在人体内经酸性水解后,得到青霉素氨基酸,其结构简式如图所示:
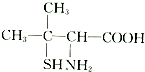
青霉素氨基酸中含有的官能团的名称为氨基、羧基.
分析 (1)①利用蛋白质盐析的性质回答;②葡萄糖中含有醛基,能发生银镜反应;③利用蛋白质的颜色反应回答;④淀粉遇碘变蓝色;
(2)①乙烯(C2H4)是植物生长的调节剂,可以催熟水果;
②白酒的主要成分为乙醇;
③铁锅在潮湿的空气中发生电化学腐蚀;
④蛋白质主要存在于动物肌肉、奶类及制品、豆类及制品中;
(3)-NH2为氨基,-COOH为羧基,据此解答即可.
解答 解:(1)①向鸡蛋清溶液里加入饱和硫酸铵溶液,发生盐析,故答案为C;
②葡萄糖和含有醛基,能发生银镜反应,故向银氨溶液中加人葡萄糖溶液后水浴加热,出现光亮的银镜,故答案为D;
③蛋白质遇硝酸显黄色,故选B;
④淀粉遇碘变蓝色,故选A;
(2)①可以作为水果催熟剂的是乙烯(C2H4),故答案为:D;
②白酒中含有乙醇,故答案为:C;
③铁锅在潮湿的空气中发生电化学腐蚀,最终生成铁锈,故答案为:A;
④鸡蛋中富含蛋白质,故答案为:B;
(3) 中含有氨基(-NH2)和羧基(-COOH),故答案为:氨基、羧基.
中含有氨基(-NH2)和羧基(-COOH),故答案为:氨基、羧基.
点评 本题主要考查了物质的组成、性质与作用,难度不大,注意知识的积累,熟悉常见的颜色反应,能准确区别蛋白质盐析与变性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标况下22.4L HF含有的分子数约为NA | |
| B. | 常温下,1L、pH=13的氨水中OH-的数目为0.1NA | |
| C. | 1mol铁与足量硫的完全反应,失去的电子数为3NA | |
| D. | 同温、同压、同体积的氢气和臭氧具有相同的分子数和原子数 |
17.甲~辛等元素在元素周期表中的相对位置如下表所示,已知甲是IA族元素,乙与己同周期,己单质在暗处与H2剧烈化合并发生爆炸.下列判断正确的是:( )


| A. | 金属性:乙>丙>丁 | |
| B. | 原子半径大小:丁>丙>乙>己 | |
| C. | 甲、乙、丙的氧化物都含有共价键 | |
| D. | 丁和乙的原子核外电子数相差16,己和辛的原子核外电子数相差26 |
4.下列对各平衡体系的建立和变化的描述正确的是( )
| A. | 常温下,氨水溶液加水稀释,$\frac{c(N{H}_{2}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$增大 | |
| B. | 2SO2(g)+O2 (g)?2SO3(g)(△H<0),其它条件不变时,升高温度,v(正)增大、v(逆)减小,平衡正向移动 | |
| C. | 某容器中存在H2(g)+I2 (g)?2HI(g)反应,当减小容器体积时,气体颜色加深,各物质的百分含量不变 | |
| D. | 25℃时Mg(OH)2的Ksp小于MgF2的Ksp,则饱和Mg(OH)2与饱和MgF2相比,前者c(Mg2+)大 |
14.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | c(H+)/c(OH-)=1012的溶液中:NH${\;}_{4}^{+}$、Al3+、NO${\;}_{3}^{-}$、Cl- | |
| B. | pH=1的溶液中:K+、Fe2+、MnO${\;}_{4}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO${\;}_{4}^{2-}$、SCN- | |
| D. | 与铝反应生成氢气的溶液中:NH${\;}_{4}^{+}$、K+、Cl-、SO${\;}_{4}^{2-}$ |
1.下列物质分类的正确组合是( )
| 分类组合 | 纯净物 | 强电解质 | 盐 | 碱性氧化物 | 分子式 |
| A | 碱石灰 | 氨水 | 纯碱 | 氧化铝 | S8 |
| B | 聚乙烯 | 碳酸钙 | 小苏打 | 氧化镁 | KCl |
| C | H2O2 | 硝酸 | 苏打 | 过氧化钠 | SiO2 |
| D | 无水硫酸铜 | 氯化银 | 碱式碳酸铜 | 氧化钠 | P4 |
| A. | A | B. | B | C. | C | D. | D |
18. 一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)═Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )
一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)═Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )
 一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)═Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )
一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)═Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | 平衡前,随着反应的进行,容器内气体的相对分子质量始终不变 | |
| B. | 平衡时,其他条件不变,取出适当铁可提高CO的转化率 | |
| C. | 该反应的△H<0,K1<K2=1.5 | |
| D. | 当反应进行到t1时刻仅改变一个条件,可能是通入了氮气 |
19.用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应Ⅰ和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表
(1)△H3=△H1-3△H2(用△H1、△H2的代数式表示);推测反应III是吸热反应(填“吸热”或“放热”)
(2)相同条件下,反应Ⅰ在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法不正确的是CD.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,NO2体积分数不变(填“变大”、“变小”或“不变”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图2. 溶液中OH-向电极a移动(填a或b),负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.

已知:反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应Ⅰ和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应Ⅰ在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法不正确的是CD.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,NO2体积分数不变(填“变大”、“变小”或“不变”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图2. 溶液中OH-向电极a移动(填a或b),负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.