题目内容
7.将29.2g粗金属钠(设杂质可溶)投入71.8g水中,产生11.2L(标准状况),请计算:(1)粗金属钠所含钠的质量分数;
(2)所得溶液中氢氧化钠的质量分数;
(3)将所得的溶液体积调至200ml,计算溶液的氢氧化钠物质的量的浓度.
分析 钠与水发生2Na+2H2O=2NaOH+H2↑,n(H2)=$\frac{11.2L}{22/4L/mol}$=0.5mol,结合反应的化学方程式计算.
解答 解:n(H2)=$\frac{11.2L}{22/4L/mol}$=0.5mol,
2Na+2H2O=2NaOH+H2↑,
2mol 2mol 2mol 1mol
n(Na) n(H2O) n(NaOH) 0.5mol
(1)n(Na)=$\frac{2mol×0.5mol}{1mol}$=1mol,m(Na)=1mol×23g/mol=23g,ω(Na)=$\frac{23g}{29.2g}×100%$=78.8%,
答:粗金属钠所含钠的质量分数为78.8%;
(2)n(NaOH)=n(Na)=1mol,m(NaOH)=1mol×40g/mol=40g,
溶液的质量为29.2g+71.8g-m(H2)=101g-0.5mol×2g/mol=100g,
ω(NaOH)=$\frac{40g}{100g}×100%$=40%,
答:所得溶液中氢氧化钠的质量分数40%;
(3)将所得的溶液体积调至200ml,c(NaOH)=$\frac{1mol}{0.2L}$=5mol/L,
答:溶液的氢氧化钠物质的量的浓度5mol/L.
点评 本题考查了钠及其化合物的计算,该题是基础性试题的考查,难度不大,侧重对学生基础性知识的巩固和训练,有利于培养学生的规范答题能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.A+、B+、C-、D-四种离子两两组成四种可溶性盐,其中AC和BD的盐溶液的pH=7,BC盐溶液pH>7,则下列说法正确的是( )
| A. | AD盐溶液pH>7 | B. | .酸的电离程度一定是HD<HC | ||
| C. | .碱的电离程度一定是AOH>BOH | D. | .在AC盐溶液中c(A+)+c(AOH)=c(C-)+c(HC) |
3.下列说法正确的是( )
| A. | 配制FeCl3溶液时,可加入少量的稀硫酸以抑制Fe3+的水解 | |
| B. | MgCl2溶液中混有少量FeCl3杂质,可向混合溶液中加入MgO以除杂 | |
| C. | 氯化铝溶液蒸干灼烧得到的固体物质还是氯化铝 | |
| D. | 无色透明溶液中,Na+、Al3+、SO42-、Cl-、ClO-、I-能大量共存 |
20.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标况下22.4L HF含有的分子数约为NA | |
| B. | 常温下,1L、pH=13的氨水中OH-的数目为0.1NA | |
| C. | 1mol铁与足量硫的完全反应,失去的电子数为3NA | |
| D. | 同温、同压、同体积的氢气和臭氧具有相同的分子数和原子数 |
1.下列物质分类的正确组合是( )
| 分类组合 | 纯净物 | 强电解质 | 盐 | 碱性氧化物 | 分子式 |
| A | 碱石灰 | 氨水 | 纯碱 | 氧化铝 | S8 |
| B | 聚乙烯 | 碳酸钙 | 小苏打 | 氧化镁 | KCl |
| C | H2O2 | 硝酸 | 苏打 | 过氧化钠 | SiO2 |
| D | 无水硫酸铜 | 氯化银 | 碱式碳酸铜 | 氧化钠 | P4 |
| A. | A | B. | B | C. | C | D. | D |
 .
.
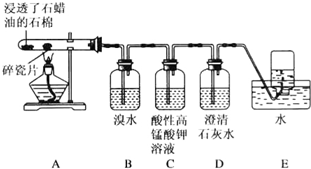
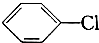 :
:
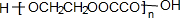
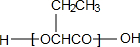 .
.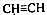 和CH3CHO(写结构简式)耗氧量相同,如氢原子数相同,等物质的量的CH4和CH3COOH、HCOOCH3、HOOCCH2COOH、HOOCCOOCH3耗氧量相同.
和CH3CHO(写结构简式)耗氧量相同,如氢原子数相同,等物质的量的CH4和CH3COOH、HCOOCH3、HOOCCH2COOH、HOOCCOOCH3耗氧量相同.