题目内容
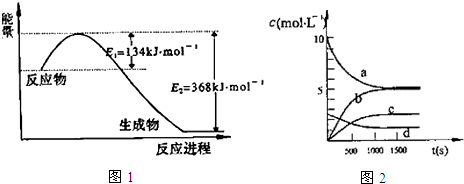
1.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.(1)如图1是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;
已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=-760.3kJ•mol-1;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
已知:K3000C>K3500C,则该反应是放热反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大 C.再充入NO2 D.再充入4mol NO2和1mol O2
③图2中表示N2O5的浓度的变化曲线是c,用O2表示从0~500s内该反应的平均速率v=0.00151 mol•L-1•s-1.
分析 (1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,可得热化学方程式:
NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1 ①
又已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1②
根据盖斯定律,2×①-②可得:2NO(g)+2CO(g)?N2(g)+2CO2(g),反应热也进行相应计算;
(2)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
已知:K300℃>K350℃,说明降低温度平衡正向移动,而降低温度平衡向放热反应方向移动;
②转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;若要增大NO2的转化率,应改变条件使平衡正向移动,但不能只增大二氧化碳的用量,否则其转化率会降低;
③N2O5是生成物,其初始物质的量浓度是0,达到平衡状态时生成N2O5物质的量=(20-10.08)mol×$\frac{1}{2}$=4.96mol,平衡时N2O5物质的量浓度=$\frac{4.96L}{2L}$=2.48mol/L;
根据v=$\frac{△c}{△t}$计算v(NO2),再利用速率之比等于其化学计量数之比计算v(O2).
解答 解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,可得热化学方程式:
NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1 ①
又已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1②
根据盖斯定律,2×①-②可得:2NO(g)+2CO(g)?N2(g)+2CO2(g),△H=(-234kJ/mol)×2-(+292.3kJ•mol-1)=-760.3kJ•mol-1,
故答案为:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;-760.3kJ•mol-1;
(2)①4NO2(g)+O2(g)?2N2O5(g)的化学平衡常数表达式K=$\frac{{c}^{2}({N}_{2}{O}_{5})}{{c}^{4}(N{O}_{2})×c({O}_{2})}$;
已知:K300℃>K350℃,说明降低温度平衡正向移动,而降低温度平衡向放热反应方向移动,故该反应为放热反应,
故答案为:$\frac{{c}^{2}({N}_{2}{O}_{5})}{{c}^{4}(N{O}_{2})×c({O}_{2})}$;放热;
②1000s时处于平衡状态,平衡时转化的二氧化氮为(20-10.08)mol=9.92mol,故二氧化氮的转化率=$\frac{9.92mol}{20mol}$×100%=49.6;
A.该反应的正反应是放热反应,降低温度平衡正向移动,能增大二氧化氮转化率,故A正确;
B.充入氦气,使体系压强增大,但反应体系中各物质浓度不变,平衡不移动,所以二氧化氮转化率不变,故B错误;
C.再充入NO2,平衡正向移动,但转化率降低,故C错误;
D.再充入4mol NO2和1mol O2,等效为增大压强,平衡正向移动,二氧化氮转化率增大,故D正确;
故答案为:49.6%;AD;
若要增大NO2的转化率,应改变条件使平衡正向移动,但不能只增大二氧化碳的用量,否则其转化率会降低;
③N2O5是生成物,其初始物质的量浓度是0,达到平衡状态时生成N2O5物质的量=(20-10.08)mol×$\frac{1}{2}$=4.96mol,平衡时N2O5物质的量浓度=$\frac{4.96L}{2L}$=2.48mol/L,故曲线c表示N2O5的浓度;
500s内v(NO2)=$\frac{\frac{(20-13.96)mol}{2L}}{500s}$=6.04×10-3mol•L-1•s-1,速率之比等于其化学计量数之比,则v(O2)=$\frac{1}{4}$v(NO2)=$\frac{1}{4}$×6.04×10-3mol•L-1•s-1=0.00151 mol•L-1•s-1,
故答案为:c;0.00151 mol•L-1•s-1.
点评 本题考查化学平衡计算与影响因素、化学平衡图象、热化学方程式及反应热计算,注意平衡常数只受温度影响,平衡常数及其单位与方程式中化学计量数有关,难度中等.

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案| A. | 最终所得两种溶液的质量不相等 | |
| B. | 标准状况下,两者产生的氢气的体积相等 | |
| C. | 两个实验中,铁粉均有剩余 | |
| D. | 比较两个实验中铁粉失去的电子数目,前者多,后者少 |
| A. | 6.0mol•L-1 | B. | 3.0mol•L-1 | C. | 9.0mol•L-1 | D. | 4.5mol•L-1 |
| A. | 实验室制取蒸馏水不需要温度计 | B. | 使用容量瓶前检查是否漏水 | ||
| C. | 用20mL量筒量取18.36mL水 | D. | 分液漏斗用于萃取和分液 |
| A. | CO(g)的燃烧热为283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=2×(-283.0)kJ•mol-1 | |
| B. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.4 kJ/mol | |
| C. | FeSO4、Na2CO3、FeCl3、Mg(NO3)2溶液加热蒸发结晶都得不到相应的溶质 | |
| D. | 由△G=△H-T△S可知,△H>0且△S<0的反应肯定不能发生 |
| A. | 过量澄清石灰水加入小苏打溶液:HCO${\;}_{3}^{-}$+OH-+Ca2+=CaCO3↓+H2O | |
| B. | 硫酸溶液中加入氢氧化钡溶液:H++SO${\;}_{4}^{2-}$+Ba2++OH-═BaSO4↓+H2O | |
| C. | 碳酸钙投入到盐酸:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| D. | 铁片加入到稀硫酸溶液中:Fe+2H+═Fe3++H2↑ |