题目内容
11.“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种.若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸
⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀 ⑦能透过半透膜.
| A. | ①④⑥⑦ | B. | ②③④ | C. | ②③⑤⑦ | D. | ①③④⑥ |
分析 纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中的一种.若将纳米碳均匀地分散到蒸馏水中形成分散系是胶体,依据胶体的特征和性质分析判断问题.
解答 解:纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中的一种.属于胶体分散质微粒直径的大小,若将纳米碳均匀地分散到蒸馏水中形成分散系是胶体,具有丁达尔现象,能透过滤纸,不能透过半透膜,具有介稳性,不生成沉淀,故②③④正确;
故选B.
点评 本题考查了胶体分散系的本质特征,胶体性质的应用,题目难度不大,分散系的本质区别是分散质微粒直径大小.

练习册系列答案
相关题目
1.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)如图1是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;
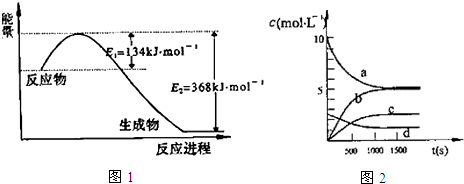
已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=-760.3kJ•mol-1;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如表:
①写出该反应的平衡常数表达式:K=$\frac{{c}^{2}({N}_{2}{O}_{5})}{{c}^{4}(N{O}_{2})×c({O}_{2})}$,
已知:K3000C>K3500C,则该反应是放热反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大 C.再充入NO2 D.再充入4mol NO2和1mol O2
③图2中表示N2O5的浓度的变化曲线是c,用O2表示从0~500s内该反应的平均速率v=0.00151 mol•L-1•s-1.
(1)如图1是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;

已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=-760.3kJ•mol-1;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
已知:K3000C>K3500C,则该反应是放热反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大 C.再充入NO2 D.再充入4mol NO2和1mol O2
③图2中表示N2O5的浓度的变化曲线是c,用O2表示从0~500s内该反应的平均速率v=0.00151 mol•L-1•s-1.
2.在烧杯中加入水和苯(苯的密度为0.88g/cm3,与水互不相溶,且不与钠反应)各50mL,将一小粒金属钠(密度为0.97g/cm3)投入烧杯中,观察到的现象可能为( )
| A. | 钠在苯与水的界面处反应并可能上浮下沉 | |
| B. | 钠停留在苯层中不发生反应 | |
| C. | 钠在苯的液面上反应并四处游动 | |
| D. | 钠在水层中反应并四处游动 |
6.某次酸雨的分析数据如下:c (NH4+)═2.0×10-5 mol/L、c(Cl-)═6.0×10-5 mol/L、c(Na+)═1.9×10-5 mol/L、c(NO3-)═2.3×10-5 mol/L、c(SO42-)═2.8×10-5 mol/L,此次酸雨的c(H+)为( )
| A. | 1.0×10-4 mol/L | B. | 2.0×10-4 mol/L | C. | 1.0×10-5 mol/L | D. | 2.0×10-5 mol/L |
16.能正确表示下列反应的离子方程式是( )
| A. | 碳酸钙加到醋酸溶液中:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 碳酸氢钙与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| C. | 浓烧碱与铝片反应:Al+2OH-=AlO2-+H2↑ | |
| D. | 铜片插入盐酸中:2H++Cu=Cu2++H2↑ |
3.下列溶液中的c(Cl-)与50mL 1mol/L FeCl3溶液中的c(Cl-)相等的是( )
| A. | 150mL 1mol/L NaCl溶液 | B. | 75mL 2mol/L NH4Cl溶液 | ||
| C. | 150mL 1.5mol/L MgCl2溶液 | D. | 75mL 2mol/L AlCl3溶液 |
20.已知KClO3+6HCl═KCl+3Cl2↑+3H2O,关于此反应的说法正确的是( )
| A. | KClO3被还原,作还原剂 | |
| B. | 氧化剂与还原剂的物质的量之比为1:6 | |
| C. | 氧化产物与还原产物的质量比为5:1 | |
| D. | 氧化性HCl>Cl2>KClO3 |
1.如表是元素周期表的一部分,针对表中元素,填写下列空白
(1)比HCl、H2S更稳定的氢化物是:HCl
(2)P、N、Mg原子半径由小到大的顺序是:N<P<Mg
(3)Cl-的离子结构示意图是: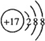
(4)最高价氧化物对应水化物酸性最强的是:高氯酸 (填名称).:
(5)形成化合物种类最多的元素是:C
(6)Si的最高价氧化物对应的水化物的化学式为:H2SiO3
(7)Na与CuSO4溶液反应的化学方程式为(分步写):2Na+2H2O═2NaOH+H2↑;2NaOH+CuSO4=Cu(OH)2+Na2SO4.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | Li | Be | B | C | N | O | F | Ne |
| 三 | Na | Mg | Al | Si | P | S | Cl | Ar |
(2)P、N、Mg原子半径由小到大的顺序是:N<P<Mg
(3)Cl-的离子结构示意图是:

(4)最高价氧化物对应水化物酸性最强的是:高氯酸 (填名称).:
(5)形成化合物种类最多的元素是:C
(6)Si的最高价氧化物对应的水化物的化学式为:H2SiO3
(7)Na与CuSO4溶液反应的化学方程式为(分步写):2Na+2H2O═2NaOH+H2↑;2NaOH+CuSO4=Cu(OH)2+Na2SO4.