题目内容
16.下列说法正确的是( )| A. | CO(g)的燃烧热为283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=2×(-283.0)kJ•mol-1 | |
| B. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.4 kJ/mol | |
| C. | FeSO4、Na2CO3、FeCl3、Mg(NO3)2溶液加热蒸发结晶都得不到相应的溶质 | |
| D. | 由△G=△H-T△S可知,△H>0且△S<0的反应肯定不能发生 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式改变方向,焓变随之改变符合;
B.从中和热的定义来判断,中和热的热化学方程式必须让生成的水为1mol;
C.加热蒸干至质量不再减少为止,能得到较纯净的原溶质,需要依据溶液中 溶质的水解、分解、氧化等反应,结合生成产物的性质分析判断;
D.在等温等压条件下,化学反应方向的判据为:△H-T△S<0反应能正向自发进行,△H-T△S=0反应达到平衡状态,△H-T△S>0反应不能自发进行.
解答 解:A.燃烧热是1mol纯净物完全燃烧生成稳定的氧化物放出的热量,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol,故A错误;
B.在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热中和热.20.0gNaOH的物质的量n=$\frac{m}{M}$=$\frac{20g}{40g/mol}$=0.5nol,与稀盐酸完全中和生成0.5mol水,此时放出热量28.7kJ,故当生成1mol水时放热57.4KJ,故该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol,故B正确;
C.FeSO4溶液中亚铁离子水解,具有还原性加热溶液被氧化为三价铁,生成氢氧化铁和硫酸,硫酸是难挥发性酸,加热蒸干至质量不再减少为止,能得到较纯净的硫酸铁溶质;Na2CO3溶液中碳酸根离子水解生成碳酸氢钠和氢氧化钠,加热蒸干至质量不再减少为止,能得到较纯净的原溶质,FeCl3溶液水解生成氢氧化铁和氯化氢,氯化氢挥发促进水解得到氢氧化铁,得不到原溶质,Mg(NO3)2溶液中镁离子水解,生成氢氧化镁和硝酸,硝酸是挥发性酸,加热蒸干至质量不再减少为止,能得到氢氧化镁,故C错误;
D.△H>0,△S<0,满足△G=△H-T•△S>0,所有温度都不能自发进行,但不是说反应一定不能发生,故D错误;
故选B.
点评 本题考查化学反应与能量问题、反应的方向、盐类的水解等知识,题目难度中等,注意中和热、燃烧热等概念的理解,掌握基础是解题关键,C注意掌握物质水溶液中的性质,不能自发进行,但不是说反应一定不能发生,D为易错题.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案(1)如图1是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;
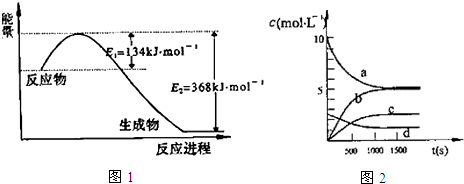
已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=-760.3kJ•mol-1;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
已知:K3000C>K3500C,则该反应是放热反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大 C.再充入NO2 D.再充入4mol NO2和1mol O2
③图2中表示N2O5的浓度的变化曲线是c,用O2表示从0~500s内该反应的平均速率v=0.00151 mol•L-1•s-1.
| A. | 氧化物:CO、NO2、SO2、H2O | |
| B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | |
| C. | 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3•H2O | |
| D. | 酸:H2SO4、HNO3、H2CO3、NaHSO4 |
①反应前后,溶液中离子浓度基本保持不变的有Na+ ②有胶状物质生成
③有气体产生 ④溶液颜色发生变化 ⑤溶液中共发生了2个氧化还原反应.
| A. | ①②③④ | B. | ①②③④⑤ | C. | ①③④⑤ | D. | ②④⑤ |
| A. | 1.0×10-4 mol/L | B. | 2.0×10-4 mol/L | C. | 1.0×10-5 mol/L | D. | 2.0×10-5 mol/L |
 只有C是金属,D的单质是黄色固体.
只有C是金属,D的单质是黄色固体.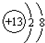 .
.